摘要:目的制备卵巢癌靶向光疗剂白蛋白纳米结合物,对其肿瘤靶向性与抗肿瘤作用进行考察。方法采用激光共聚焦显微镜、流式细胞术和溶酶体标记观察纳米结合物的细胞摄取及机制,通过AlamarBlue法和CalceinAM/PI染色考察其细胞毒作用,通过观察活性氧的生成和细胞凋亡考察纳米结合物的抗肿瘤机制。构建SKOV-3-NIH-3T3/GFP肿瘤球模型观察纳米结合物的肿瘤靶向性。结果cRGD-PEG-HSA-IR700在整合素过表达的SKOV-3细胞的摄取为PEG-HSA-IR700的4.8倍,摄取后主要分布于溶酶体,两者在整合素不表达的NIH-3T3细胞摄取均较少。在考察浓度范围内,游离IR700、PEG-HSA-IR700与cRGD-PEG-HSA-IR700未光照组均未见细胞毒性,而cRGD-PEG-HSA-IR700光照组细胞毒作用明显,这是由于光照引起细胞内活性氧的生成以及诱导细胞凋亡的发生。结论该白蛋白纳米结合物具有肿瘤特异性,有望成为肿瘤靶向光动力学治疗的药物传递新平台。
关键词:光动力学疗法;卵巢癌靶向;白蛋白纳米结合物;抗肿瘤
光动力学疗法(photodynamictherapy,PDT)是临床批准的一种肿瘤治疗手段,因其在抗恶性肿瘤领域的巨大潜力而得到广泛的关注。当光疗剂在肿瘤聚集后,以特定波长的光照射诱导能量转换产生具有细胞毒性的单线态氧和/或氧自由基,从而导致肿瘤细胞死亡[1-2]。作为一种微创治疗手段,光动力学疗法优点较多,如副作用小且持续时间短[1-2]、可重复治疗、治疗费用较放疗与化疗低、能够损伤微血管切断肿瘤部位氧及营养物质的供给等[3]。但是,光动力学疗法缺乏肿瘤特异性,故而限制了它的广泛应用。为此,我们亟待找到能够克服光动力学疗法内在缺陷提高其肿瘤特异性的新策略。
运用主动靶向策略将光疗剂传递至肿瘤可降低光动力学治疗对正常组织的毒性作用。整合素为主要的跨膜细胞黏附和信号受体蛋白,由α与β亚基组成,在哺乳动物体内存在24种整合素二聚体[4],约半数的整合素通过与RGD序列的结合而连接细胞外基质与细胞骨架[5]。它在肿瘤进展中发挥了重要作用,如通过与细胞外基质的结合参与肿瘤的增殖、侵袭与转移[6]。一些整合素如αvβ3和αvβ5在新生血管与某些肿瘤如卵巢癌过度表达[7],而RGD序列能够被半数的整合素识别,因此,整合素被用作肿瘤特异性传递化疗药物的主要靶点之一[8],而RGD肽成为肿瘤诊断与治疗常用的靶头[9-10]。
白蛋白具有无免疫原性、生物可降解、肿瘤特异性、降低药物毒性、维持药物的治疗浓度等优点[11],是用于肿瘤治疗的一种多功能载体。本实验以人血清白蛋白(humanserumalbumin,HSA)为载体、IRDye700DX(IR700)为光疗剂、cRGD为靶头、PEG为连接臂合成了肿瘤靶向的白蛋白纳米结合物cRGD-PEG-HSA-IR700,通过对其形态、粒径、细胞摄取行为与机制、细胞毒作用、肿瘤靶向性及光动力学治疗的机制等进行系统地考察,为其用于肿瘤靶向光动力学治疗提供依据。
1仪器与材料
1.1仪器
MS104TS电子天平(瑞士MettlerToledo公司);SorvallST8R离心机、HERACellVIOS160i细胞培养箱(美国ThermoScientific公司);透射电镜(美国FEITecnai公司);Cytation5细胞成像微孔板检测系统(美国BioTek公司);IX83倒置荧光显微镜、FV1200激光共聚焦显微镜(日本Olympus公司);ZetasizerNanoZS90激光粒度测定仪(英国MalvernInstruments公司);FACSCantoII流式细胞仪(美国BD公司)。
1.2材料
HSA、半胱氨酸(美国Sigma公司);IRDye700DX-NHS(美国LI-COR生物科学公司);c[RGDfK(Ac-SCH2CO)](美国PeptidesInternational有限公司);LysoTrackerGreen和Hoechst33342(美国LifeTechnologies公司);Mal-PEG-SCM(美国CreativePEGWorks公司);PierceTMBCA蛋白测定试剂盒(美国ThermoScientific公司);胎牛血清、DMEM培养基、McCoy's5A培养基、青霉素+链霉素双抗和胰酶(美国Gibco公司);InvitrogenTMalamarBlue细胞活性试剂、CalceinAM/PI活细胞/死细胞双染试剂盒、活性氧荧光探针CM-H2DCFDA(美国ThermoFisherScientific公司)。
1.3细胞株
NIH-3T3小鼠胚胎成纤维细胞系与人卵巢癌SKOV-3细胞株均购自美国标准生物品收藏中心(ATCC)。
光诱导卵巢癌靶向白蛋白纳米结合物的抗肿瘤研究相关论文推荐:动脉灌注化疗如何治疗妇科肿瘤
2方法与结果
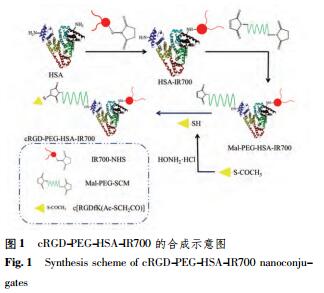
2.1cRGD-PEG-HSA-IR700的合成
cRGD-PEG-HSA-IR700纳米结合物的合成见图1。将HSA溶于pH7.4的磷酸盐缓冲液后,加入IR700-NHS室温孵育1h。继而按HSA/PEG摩尔比1∶30[12]加入Mal-PEG-SCM,并室温孵育1h。中间产物经ZebaTM脱盐柱(40000MWCO)纯化后,按cRGD/HSA摩尔比40∶1[12]投入经盐酸羟胺活化的cRGD,在磁力搅拌下反应30min,反应产物经ZebaTM脱盐柱纯化即得。由半胱氨酸与中间产物反应制得的PEG-HSA-IR700作为非靶向对照。合成中取适量中间产物HSA-IR700纯化后,用BCA法测定HSA的浓度,用紫外-可见分光光度法测定IR700的浓度,结果表明,每个HSA分子约共价连接3个IR700。
2.2cRGD-PEG-HSA-IR700的表征
取合成的cRGD-PEG-HSA-IR700适量,用去离子水稀释至适宜浓度,取一滴稀释液于铜网上,用滤纸轻轻拭干后,用2%磷钨酸染色30s,自然晾干后于透射电镜下观察纳米粒的形态并拍照。另取适量cRGD-PEG-HSA-IR700用NanoZS90激光粒度测定仪测定纳米结合物的粒径。白蛋白纳米结合物的透射电镜照片见图2A,其粒径分布见图2B。结果表明,cRGD-PEG-HSA-IR700的粒径为(10.73±0.89)nm,PDI为(0.216±0.002)。
2.3cRGD-PEG-HSA-IR700的细胞摄取及摄取机制考察
取对数生长期的人卵巢癌SKOV-3细胞,用胰酶消化并以McCoy's5A培养基中和,以1000r·min-1离心后吸除上清液,以McCoy's5A培养基分散细胞并计数。按1×105个细胞·皿-1的密度将SKOV-3细胞接种于激光共聚焦皿中,孵育过夜后,分别向各皿中加入500nmol·L-1(以IR700计)的IR700、PEG-HSA-IR700和cRGD-PEG-HSAIR700溶液,孵育6h后,吸除药液,加入新鲜的McCoy's5A培养基,再用Hoechst33342染核20min后,置于激光共聚焦显微镜下观察并拍照。以NIH-3T3细胞为对照,结果见图3A,细胞核均被Hoechst33342染成了蓝色,除cRGD-PEG-HSAIR700与SKOV-3细胞共孵育组观察到强烈的红色荧光信号外,其余各组均未见IR700信号,表明各IR700制剂在NIH-3T3细胞摄取均较少,cRGDPEG-HSA-IR700能够被SKOV-3细胞很好地摄取,而SKOV-3细胞对IR700与PEG-HSA-IR700的摄取亦较少。
采用流式细胞术定量考察cRGD-PEG-HSAIR700的细胞摄取行为。按1×105个细胞·孔-1的密度将SKOV-3细胞接种于12孔板中,孵育过夜后,分别向各孔中加入500nmol·L-1(以IR700计)的PEG-HSA-IR700、cRGD-PEG-HSA-IR700和cRGD-PEG-HSA-IR700+5μMcRGDyK溶液,孵育6h后,吸除药液并用冷PBS漂洗3次,再以胰酶消化后用流式细胞仪分析。以未经药物处理的细胞为对照。流式细胞仪测定的结果见图3B,与对照组相比,SKOV-3细胞对PEG-HSA-IR700与cRGD-PEG-HSA-IR700的摄取分别增加了5.5倍和30.6倍。另外,游离RGD的存在使得SKOV-3细胞对cRGD-PEG-HSA-IR700的摄取降为原来的35.7%。
采用溶酶体标记法考察cRGD-PEG-HSAIR700的细胞摄取机制。按每皿1×105个细胞的密度将SKOV-3细胞接种于激光共聚焦皿中,孵育过夜后,向各皿中分别加入500nmol·L-1(以IR700计)的cRGD-PEG-HSA-IR700溶液,孵育6h后移除药液,并加入LysoTrackerGreenDND-26溶液染色20min,以新鲜McCoy's5A培养基置换后用激光共聚焦显微镜观察并拍照。cRGD-PEG-HSA-IR700与LysoTrackerGreenDND-26在SKOV-3细胞内共定位的激光共聚焦照片见图3C,溶酶体呈现绿色荧光,IR700呈现红色荧光,在合并的图片上出现许多黄色的荧光点,表明cRGD-PEG-HSA-IR700摄取入胞后主要分布于溶酶体。
2.4cRGD-PEG-HSA-IR700的细胞毒作用
按每孔5×103个细胞的密度将SKOV-3细胞接种于96孔板中,孵育过夜后,分别向细胞中加入系列浓度(以IR700计)在0.61~1333.3nmol·L-1的IR700、PEG-HSA-IR700和cRGD-PEG-HSA-IR700溶液100μL,37℃孵育24h后吸除药液,换以新鲜培养基,再用660nm的LED灯照射20min(3.5mW·cm-2),孵育过夜后向每孔中加入alamarBlue试液100μL,继续孵育2h后吸出alamarBlue试液,以激发/发射波长为560/590nm测定荧光强度。以未给药的细胞为空白对照,分别计算细胞存活率。以NIH-3T3细胞为对照,除使用DMEM培养基外,其他细胞毒测定的操作方法同SKOV-3细胞。结果表明,在考察浓度范围内,各IR700制剂对NIH-3T3细胞均未呈现出明显的毒性作用;IR700与PEGHSA-IR700亦未对SKOV-3细胞产生毒性作用,但是,cRGD-PEG-HSA-IR700对SKOV-3细胞表现出显著的毒性作用,且呈现浓度依赖性(图4)。该发现与激光共聚焦显微镜观察的结果以及流式细胞仪测得的数据相符。
为了更直观地观察各IR700制剂对SKOV-3细胞的毒性作用,采用CalceinAM/PI双染细胞。将SKOV-3细胞接种于24孔细胞培养板,待细胞贴壁后,向各孔中分别加入500nmol·L-1(以IR700计)的PEG-HSA-IR700与cRGD-PEG-HSA-IR700溶液,孵育过夜后,换新鲜培养基,再用660nm的LED灯照射20min(3.5mW·cm-2),孵育过夜后,向各孔中加入CalceinAM/PI溶液于37℃染色20min,再换以新鲜培养基,用Cytation5细胞成像微孔板检测系统观察拍照。另取平行操作的细胞给予药液,但不给予光照作为对照。结果见图5,绿色荧光为活细胞信号,红色荧光为死细胞信号,未经光照处理的细胞均仅呈现绿色荧光,而光照处理的细胞仅有cRGD-PEG-HSA-IR700组出现强烈的红色荧光,表明SKOV-3细胞只有在同时给予cRGD-PEG-HSAIR700与光照时才表现出毒性作用,而PEG-HSAIR700与未经药物处理组的细胞无论光照与否均无明显毒性作用。
转载请注明来自:http://www.lunwencheng.com/lunwen/yix/15585.html