「摘要」目的探讨人胚胎干细胞(hESC)体外诱导制备成熟红细胞的潜能。方法通过三阶段方案诱导hESC向红细胞分化,并通过流式细胞术检测造血干/祖细胞及红细胞表面标志物的变化,通过细胞染色和形态学分析判断红细胞的成熟程度;用实时定量PCR(qRT⁃PCR)分析不同时间点关键调控基因和珠蛋白链的表达,并以高效液相色谱法(HPLC)检测诱导所得红细胞(cRBC)不同珠蛋白链的表达量;应用血氧分析仪对诱导所得红细胞的血红蛋白(cRBC⁃Hb)进行功能分析。结果定向诱导可获得CD235/CD71双阳性>80%的红细胞,细胞具有红系细胞形态和携氧能力,但hESC诱导获得的cRBC中β类珠蛋白的表达以γ⁃珠蛋白为主,cRBC⁃Hb氧饱和度为50%时的氧分压(P50)也低于成人Hb标准品检测值。实时定量PCR检测发现,伴随诱导过程胚胎干细胞干性基因表达迅速下调,与造血干细胞自我更新、增殖、分化相关基因SCF、HOXB4、Notch⁃1、Runx1、WNT5、PU.1和SCL,以及红系定向分化调控基因EPOR、EKLF、GATA1和MYB阶段性开启表达,但调控成人型β⁃珠蛋白表达的EKLF和BCL11A在诱导结束阶段处于较低的表达水平。结论hESC在体外能向红系诱导分化,关键调控基因程序化地表达,hESC具有体外制备功能红细胞的潜能,但现有的诱导体系获得的cRBC类似于胎儿红细胞。
[关键词]人胚胎干细胞(hESC);红细胞;血红蛋白类;珠蛋白类;体外诱导;色谱法,高压液相
红细胞(redbloodcells,RBC)输注是临床广泛应用的治疗措施,包括急性出血、贫血或低蛋白血症、重症感染及凝血功能障碍等均为RBC输注治疗的适应证。目前血液的供应仍依靠志愿者的捐赠,这使得RBC在世界范围内依然处于短缺状态。近期的LancetHaematology杂志分析显示,2017年全球输血需求为3亿单位,而供应量仅有2.7亿单位,更重要的是,全球195个国家中有119个国家的血液供应存在不足情况,在这119个国家中,实际的血液制品需求缺口达1亿单位[1]。同时因血液储存而出现的问题、输血导致的传染性疾病及输血相关并发症依然威胁着患者的生命健康。因此,可供临床应用的体外血液制备成为目前的关注热点。
迄今证明,包括脐带血、外周血和骨髓来源的造血干/祖细胞(hematopoieticstem/progenitorcells,HSPC),以及包括胚胎干细胞(embryonicstemcells,ESC)和诱导多能干细胞(inducedpluripotentstemcells,iPSC)在内的多能干细胞(pluripotentstemcells,PSC)都具有分化为终末血液细胞的能力。PSC由于可在体外长期培养扩增,并维持其多向分化能力,已成为极具应用前景的种子细胞[2]。
早在2008年就分别有两项报道证实,诱导人ESC可制备出RBC。其中Ma等[3]研究显示,在基质细胞辅助下,约98%人胚胎干细胞(hESC)体外诱导的RBC能表达成人型血红蛋白(adulthemoglobin,HbA)。然而更多的研究则提示,ESC或iPSC诱导获得的RBC与卵黄囊或胎肝阶段造血产生的RBC类似,细胞的扩增水平偏低、细胞脱核比例低、体积偏大,且细胞中主要表达胎儿型血红蛋白(fetalhemo⁃globin,HbF)[4]。这些问题的存在将限制人PSC诱导制备的RBC的临床应用。因此,确定人PSC定向诱导RBC的发育特征及其关键的调控因素,将为进一步提高这些RBC的成熟水平、推进临床应用提供重要的理论依据。
本研究以hESCH1为种子细胞,体外向RBC诱导分化,并对诱导细胞的基因表达及功能进行检测,确定PSCH1来源的RBC的成熟水平,分析关键调控因素,为RBC的体外制备提供思路。
1材料与方法
1.1材料
Matrigel基质胶、IMDM(Iscove′smodifiedDu⁃becco′smedium)培养基、PBS缓冲液、F⁃12(Ham′sF12nutrientmedium)培养基、AdvancedDMEM/F⁃12(Dulbecco′smodifiedeaglemedium/Ham′sF⁃12)培养基、DMEM/F⁃12(Dulbecco′smodifiedeaglemedium/nutrientmixtureF⁃12)培养基(均美国Gibco公司);流式抗体CD71⁃APC、CD235⁃BV421、CD34⁃PE(均eBioscience公司);SSEA4⁃APC、Tra⁃1⁃60PE(美国BD公司);Accutase细胞解离剂、mTeSR™Plus基础培养基(均StemCell公司);干细胞因子(stemcellfactor,SCF);血小板生成素(thrombopoietin,TPO)、FMS样酪氨酸激酶3配体(FMSliketyrosinekinase3ligand,Flt⁃3L)、GlutaMAX添加剂、碱性成纤维生长因子(basicfibroblastgrowthfactor,bFGF)(均Peprot⁃ech公司);骨形态发生蛋白4(bonemorphogeneticprotein4,BMP4)、血管内皮生长因子(vascularendo⁃thelialgrowthfactor,VEGF)、激活素A(activinA)(均RD公司);L⁃抗坏血酸2⁃磷酸(ascorbicacid2⁃phos⁃phate,AA2P)、白细胞介素⁃3(IL⁃3)、转铁蛋白(均Sigma公司);促红细胞生成素(EPO)、OCT4和NANOG兔抗人抗体(CST公司);SOX2兔抗人抗体(Abcam公司);RNeasyMicroKit(Qiagen公司);Re⁃verTraAceqPCRRTMasterMix试剂盒、THUNDER⁃BIRDSYBRqPCRMix(TOYOBO公司);糖原合酶激酶⁃3抑制剂(CHIR99021)、选择性ALK5抑制剂(SB431542)、选择性ROCK1抑制剂(Y⁃276322HCL)(均Selleck公司)。
超净工作台(赫尔滨东联公司);CO2培养箱(德国ThermoFisher公司);离心机(KR/702J,Kubota公司);倒置相差显微镜(日本Nikon公司);流式细胞仪(美国BD公司)。
1.2方法
1.2.1细胞培养200μlMatrigel溶解于20mlDMEM/F12中,混匀后取1ml包被6孔培养板,室温孵育1h后,接种hESC入板孔,加2mlmTesRPlus培养基进行常规培养,待细胞密度长至约80%,用Accutase消化传代或机械法传代,细胞于37℃、5%CO2恒温培养箱中进行培养。
1.2.2hESC的诱导分化通过三阶段诱导法将hESC⁃H1经历中胚层(mesoderm)、生血内皮细胞(hemogenicendothelialcells,HEC)、造血干/祖细胞(hematopoieticstem/progenitorcells,HSPC)、诱导培养红细胞(culturedRBCs,cRBC)。将稳定培养的hESC消化成单细胞,以2×105/ml细胞密度接种于低吸附6孔板内,并添加终浓度为10μmol/LY27632,记为诱导第0天。培养24h后,600r/min室温离心5min更换第一阶段培养基。第3天离心更换第二阶段培养基。第7天离心更换第三阶段培养基,至第21天。
相关知识推荐:哪些医学期刊容易投稿
具体培养方案如下:第0~3天,AdvancedDMEM/F⁃12培养基中加入50μg/mlAA2P、1×Gluta⁃max添加剂、25ng/mlbFGF、25ng/mlBMP4、25ng/ml激活素A、2μmol/L糖原合酶激酶⁃3抑制剂;第3~7天,AdvancedF⁃12培养基中加入50μg/mlAA2P、1×Glutamax添加剂、25ng/mlbFGF、50ng/mlVEGF、2μmol/L选择性ALK5抑制剂;第7~21天,BEL基础培养基的基础上加入50ng/mlSCF、20ng/mlTPO、20ng/mlFlt⁃3L、20ng/mlIL⁃3、20ng/mlVEGF、10μmol/L选择性ALK5抑制剂、5U/mlEPO、100ng/ml转铁蛋白。
1.2.3免疫荧光技术检测胚胎干细胞特异性标志物将细胞克隆接种于共聚焦小皿过夜,用PBS洗涤细胞2次,以4%多聚甲醛固定15~20min,用PBS洗涤细胞3次,每次5min,加山羊血清(1∶10稀释)工作液封闭,室温孵育15~30min,用于中和非特异性结合位点,加山羊血清1∶100稀释的一抗(兔抗人SOX2、OCT4和Nanog抗体)孵育,4℃过夜。用PBS洗涤细胞3次,每次5min,加1∶50稀释的荧光标记的二抗(山羊抗兔AlexaFluor568IgG抗体),避光孵育1h,用PBS洗涤细胞3次,每次5min,每皿加1.5mlPBS,立即在荧光显微镜下观察结果。
1.2.4流式细胞术检测胚胎干细胞、造血干/祖细胞及红细胞特异性标志物
1.2.4.1人胚胎干细胞特异性标志物检测当稳定培养的hESC生长至孔板约80%时,以单细胞形式收取细胞,通过流式细胞术检测干细胞标志物SSEA4和Tra⁃1⁃60的表达情况。取(2~5)×105个细胞于100μlPBS中重悬,加SSEA4⁃APC2μl;Tra⁃1⁃60PE1μl;充分混匀后置4℃避光染色30min~1h,用PBS洗涤细胞2次,移弃上清,200μlPBS重悬,准备上机检测。
1.2.4.2诱导不同阶段造血干/祖细胞及红细胞特异性标志物检测分别在诱导分化的0、3、7、10、13、16、19、21d采用流式细胞术检测红系标志物CD71/CD235a的表达情况。取(2~5)×105个细胞于100μlPBS中重悬,加CD71⁃APC2μl;CD235⁃BV4211μl及CD34⁃PE1μl;充分混匀后置4℃避光染色30min~1h,用PBS洗涤细胞2次,移弃上清,200μl重悬,准备上机检测。
1.2.5瑞氏⁃吉姆萨染色将细胞以1×106/ml的细胞密度悬于1.5mlEP管内,取50μl于细胞涂片机离心柱内,1000r/min离心3min。根据试剂盒说明,吉姆萨A液染色1min,吉姆萨B液2倍加入与A液混匀染色9min,自来水冲洗,自然晾干,显微镜下观察并拍照记录。
1.2.6血红蛋白高效液相色谱(HPLC)分析利用低渗原理破裂红细胞提取血红蛋白(Hb),吸取50μl全血或等同于50μl血量的诱导RBC(约3×108),加1ml纯水,吹打混匀;室温,3000r/min离心5min;吸取上清,移至1.5ml新离心管中,D280法检测蛋白浓度;取3mgHb溶于5mlPBS内,参照文献[5]方法,由北京清析技术研究院使用液相色谱仪(Wa⁃terse2695+2489+2476)完成上样和分析。
1.2.7实时定量PCR反应(qRT⁃PCR)分别在0、3、7、10、13、16、19、21d收集细胞沉淀,按RNeasyMicroKit试剂盒提取总RNA,检测D值后按Rever⁃TraAceqPCRRTMasterMix试剂盒将RNA逆转录为cDNA,使用THUNDERBIRDSYBRqPCRMix配制qRT⁃PCR体系,通过qRT⁃PCR仪检测基因表达,所引物序列见表1。
1.3统计学分析
使用GraphPad⁃Prism9软件进行数据处理,数据以xˉ±sxˉ表示,采用重复测量资料方差分析,以P<0.05为差异具有统计学意义。
2结果
2.1hESC的培养和鉴定
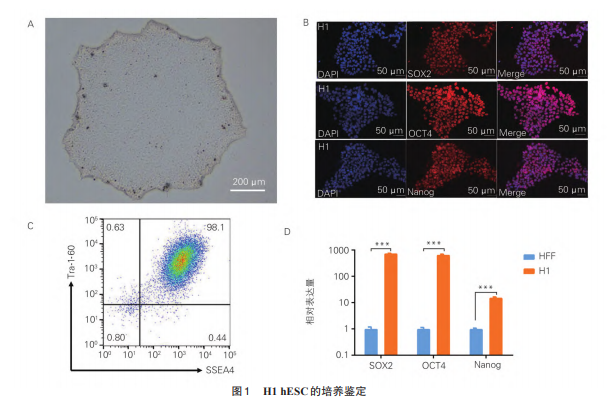
光镜下观察,稳定传代培养10代的hESC细胞呈团块样增长,边界清晰,细胞核大,核仁明显,结构致密(图1A)。对hESC克隆进行免疫荧光法检测分析,发现hESC经体外培养数代后,其特异性标志SOX2、OCT4及Nanog均呈阳性表达(图1B)。对hESC进行流式细胞术检测,发现细胞表面干性标志物SSEA4和Tra⁃1⁃60双阳性率为98.1%(图1C)。对hESC进行qRT⁃PCR分析,发现相较于成人包皮成纤维细胞(humanforeskinfibroblasts,HFF),hESC的3种干性基因SOX2、OCT4和Nanog均显著高表达(图1D)。上述结果表明,体外培养多代的hESC仍保留干细胞特征,维持稳定未分化状态。
2.2hESC向红系细胞定向诱导分化与表型分析
hESC向RBC定向诱导的培养阶段展示如图2A。将消化成单细胞的hESC在含有Y⁃27632ROCK1抑制剂的培养基中培养24h后聚合形成边缘清晰,中心透亮的拟胚体(embryoidbodies,EB);培养至第16天,细胞离心沉淀转变为红色,提示Hb的表达和RBC的出现(图2B);在诱导培养基内培养至第3天,观察到EB体积变大,数量变多;培养至第7天,可见有散在单细胞出现在EB外,为血液谱系的悬浮细胞,EB数量及体积减少(图2C)。对处于诱导分化不同时间点的细胞进行瑞氏⁃吉姆萨染色,显示细胞逐渐从原红细胞向早幼红细胞→中幼红细胞→晚幼红细胞分化,对应的胞体体积由大到小;胞质由细致、疏松变为粗糙、紧密;核膜由边界不清变为边界明显;胞核由大变小。细胞培养至第21天时,细胞核凝集并偏向胞质一侧,出现脱核趋势(图2D)。
对诱导过程中不同时间点的细胞进行流式细胞术检测,CD34作为造血干祖细胞的主要标志物在第7天开始出现,标志着红系发育开始进入造血干祖细胞阶段,在第10天达到20.9%后CD34表达逐渐降低,提示HSPC已进一步发育分化。CD71和CD235为红细胞表面特异性标志物,通常由原红细胞到网织红细胞的发育经历CD71+CD235-、CD71+CD235+和CD71-CD235+几个阶段[6],诱导过程中,CD71+单阳细胞群首先出现并逐渐增多,随后CD71+/CD235+双阳细胞群出现,于第16天达2.8%,表明已分化产生多染性红细胞及正染性红细胞,红系发育进入终末阶段。上述结果说明,hESC向红系诱导分化较为成功(图2E)。
2.3培养红细胞(cRBC)的血红蛋白表达分析
Hb含有2对珠蛋白链:α链和β链,不同珠蛋白的表达决定了Hb是胎儿型(HbF)还是成人型(HbA)。我们在诱导过程中选取不同时间点进行qRT⁃PCR,检测Hb各类珠蛋白的表达情况,发现珠蛋白在诱导第7天出现少量表达,表达随诱导时间上升明显(图3A)。特定时间点上各类珠蛋白的相对表达水平以α⁃珠蛋白为参照分析显示,ε⁃珠蛋白在第7天表达略高于γ⁃珠蛋白,继而维持在表达低于γ⁃珠蛋白的水平;β⁃珠蛋白始终少量表达,但随着诱导时间也存在略微上调的趋势。在检测时间范围内,各类β样珠蛋白中主要表达γ珠蛋白(图3B)。
HLPC分析诱导第21天的cRBC,显示这些细胞主要表达γ⁃珠蛋白,仅表达很少量的β珠蛋白,与qRT⁃PCR结果一致(图3C)。
提取诱导终点(D21)cRBC的血红蛋白,通过血氧分析仪绘制cRBC⁃Hb氧解离曲线,分析P50值。结果显示,cRBC的P50为8.84mmHg,小于HbA标准品检测值14mmHg[7](图3D)。氧解离曲线较标准曲线左移,提示hESC来源的RBC更倾向于表达HbF,HbF有利于摄取氧,而不利于氧释放。
2.4hESC定向红细胞诱导分化过程中关键调控基因的表达情况分析
选取诱导过程中代表不同发育阶段的多个时间点进行qRT⁃PCR,检测红系发育调控基因的表达。结果显示,胚胎干细胞干性相关基因SOX2、OCT4、Nanog在诱导开始后表达均迅速下调,与细胞分化状态一致。调控造血干细胞自我更新的关键因子SCF在诱导第7天即进入表达高峰,随后随细胞的成熟下调,与第二阶段的诱导相对应。多个调控造血干细胞增殖和分化的关键因子,包括HOXB4(D10降低)、Notch⁃1、Runx1、WNT5、PU.1及SCL,均在诱导的第13或16天出现表达高峰,体现出造血细胞分化的特性。EPOR、EKLF、GATA1及MYB与红系的定向分化相关,其中EPOR、GATA1和MYB均在诱导的第3阶段明显上调,并持续到检测的最后时间点(D21),与RBC的发育成熟情况一致,但EKLF在诱导第13天就达到表达顶峰,之后则出现明显下调。BCL11A是抑制γ⁃珠蛋白表达从而实现γ向β转化的重要分子,在诱导最后的时间点略有升高(D13增高,D16降低,D21再次增高),但整体处于低水平表达,也与γ⁃珠蛋白的高表达、β⁃珠蛋白的低表达相对应(图4)。——论文作者:杨舟1,3,徐蕾1,3,曲洺逸2,3,张博文2,3,李慧琳1,3,范增1,3,何丽娟1,3,岳文1,3,谢小燕1,3,裴雪涛1,3
转载请注明来自:http://www.lunwencheng.com/lunwen/yix/19845.html