摘要:采用高通量测序技术对养猪场废水处理系统的细菌群落组成进行分析,同时对细菌群落、污水水质和抗生素含量相关性进行分析.研究结果表明, 污水各处理单元中的菌群结构存在显著差异,且细菌菌群结构随处理进程逐步改变,其中集污池与厌氧反应器的细菌菌群优势门类为 Firmicutes、 Bacteroidetes 和 Proteobacteria,曝气池的细菌菌群优势门类变为 Firmicutes、Verrucomicrobia、Bacteroidetes、Proteobacteria 和 Candidatus Saccharibacteria, 氧化塘的细菌菌群优势门类为 Firmicutes、Proteobacteria、Chloroflexi、Euryarchaeota 和 Bacteroidetes.相关性分析结果表明,污水中的细菌群落与水质环境因子之间存在显著相关(P<0.05).其中,种属 Acinetobacter、Bacteroides、Prevotella、Lachnospiracea_incertae_sedis 与 COD、TN、NH4 + -N 呈显著正相关,Clostridium sensu strict、Methanothrix 与 TN、NH4 + -N 呈显著负相关,Petrimonas、Lachnospiracea_incertae_sedis、Clostridium XlVa、Tissierella 与磺胺甲恶唑、磺胺间甲氧嘧啶、强力霉素、土霉素呈极显著正相关,Acinetobacter、Bacteroides、Prevotella 与恩诺沙星、四环素呈显著正相关,Prevotella、 Lachnospiracea_incertae_sedis 与环丙沙星呈显著正相关,Clostridium sensu stricto、Petrimonas 与氧氟沙星呈显著正相关.
关键词:养猪废水;细菌群落;水质;抗生素
近年来,随着我国畜禽养殖业的迅猛发展,其污染排放问题也日趋严重[1].畜禽养殖污水不仅富含化学需氧量(COD)、总氮(TN)、氨氮(NH4 + -N)、总磷(TP)等常规污染物,还含有大量的抗生素和各种病原菌,对公共健康和生态安全构成严重威胁[2].研发经济高效的畜禽养殖废水处理工艺已成为养殖企业和环保行业的研究热点,且已开发出包括 UASB-SBR、ABR-MABR、AMBR-MABR 等在内的多种处理工艺[3-7].然而,目前的畜禽养殖废水处理工艺开发主要从工程角度进行设计,鲜有考虑微生物群落结构和功能及其与环境因素的响应规律[8].
在污水处理系统中,微生物是污染物去除的主体,系统的处理效果、稳定运行和出水安全性与其中的微生物群落结构及其功能紧密相关[8-9].Fang 等[10] 和 Liu[11]等的研究结果均显示特定的微生物菌群能够促进废水处理系统中某些复杂大分子有机化合物的降解.因此,分析养殖废水处理系统各单元细菌群落组成、明确占主导地位的细菌群落以及细菌群落与污染物浓度之间的关联性,对优化废水处理系统菌群结构,提高水质净化效率具有重要作用[12].但目前对养殖废水处理过程中微生物群落结构及其丰度变化的研究仍少见报道.
传统细菌培养法在养殖废水微生物研究中的应用较多[13].然而由于细菌在自然条件的生长情况与培养基不同,以及自然界中大多数微生物不可培养,使得传统的分离培养方法很难对处理系统中各单元的优势种群及其差异进行识别[14].近几年,随着高通量测序及其分析技术的发展,国内外学者通过高通量技术在土壤、肠道微生物、极端环境等多种复杂介质中微生物群落的研究都取得了较好的进展[15-17].因此,本文拟采用高通量测序技术对某稳定运行养猪废水处理系统中的微生物群落结构进行分析,以期明确各处理单元中起主导作用的细菌及其在整个处理过程中的动态变化;同时通过相关性分析对环境因子和微生物群落的变化进行分析,探索对污染物质降解起重要作用的功能微生物,以期发现微生物群落变化的主要推动力.
1 材料与方法
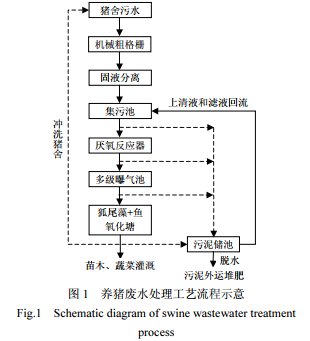
1.1 养殖废水处理工艺流程
选择福建省三明市一家典型的规模化生猪养殖场为研究对象,该养猪场的生猪养殖规模约 5000 头,废水排放量为 80m3 /d.养猪场废水处理工艺流程见图 1,养殖废水通过管道进入机械粗格栅拦截废水中的大颗粒物质及纤维状污染物,出水用振动筛挤压分离机进行固液分离,分离后的液体进入集污池继续沉淀废水中的部分细小颗粒,集污池中的污水经管道进入厌氧反应器中进行厌氧发酵,排除的沼液通过管道依次进入一级、二级、三级曝气池,经曝气处理后的污水进入氧化塘进行深度净化,氧化塘中种植穗花狐尾藻(Myriophyllum spicatum)以及养殖胡子鲶(Clarias fuscus),最终出水达到《畜禽养殖业污染物排放标准》(GB 18596-2001)[18],用于猪舍冲洗和周边苗木、蔬菜灌溉.
1.2 水样采集
依据处理系统的运行情况,于 2018 年 1 月 19 日进行 1 次系统地样品采集,共采集 12 个点,其中在集污池、厌氧反应器、三级曝气池、氧化塘各取 3 个, 采样点布置在处理单元的出水口或出水口一侧,样品保存方法参考文献[19],在 0~4℃条件下保存运输,48h 内完成污水水质和抗生素的检测分析.
1.3 微生物菌群分析
1.3.1 DNA 提取、PCR 扩增和高通量测序 收集的水样通过 0.45µm 微孔滤膜进行过滤,取滤膜采用 PowerWater DNA Isolation kit(MOBio, CarIsbad, CA, USA)进行提取,提取过程参考操作说明书进行.提取得到的 DNA 样品浓度和质量采用 Qubit 2.0 Fluorometer(Invitrogen, Carlsbad, CA, USA)检测,将符合试验要求的 DNA 样品送生工生物工程(上海) 股份有限公司扩增,PCR 扩增采用 16S rRNA 基因 V3~V4 区的通用引物 341F(5′-CCCTACACGCTCTTCCGATCTG (barcode) CCTACGGGNGGCWGCAG-3′) 和 805R(5′-GACTGGAGTTCCTTGGCACCCGAGAATTCCA (barcode) GACTACHVGGGT- ATCTAATCC-3′).PCR 产 物使用 QIAquick PCR Purification kit(Qiagen, Düsseldorf, Germany)进行纯化.纯化后的 PCR 产物采用 Illumina MiSeq 测序平台进行高通量测序,原始数据提交 NCBI’s Sequence Read Archive(SRA)数据库保存,序列号 SRP151692.
1.3.2 高通量数据处理 Illumina MiSeq 测序数据首先使用 FLASH 软件[20]进行拼接,之后运用 cutadapt 软件[21]裁切序列中的正反向引物,使用 Prinseq 软件 [22]质控去除 Q score<20 的低质量序列, 然后使用 Usearch 软件[23]去除嵌合体以及按 97%序列相似度划分分类操作单元(OTUs).利用 Ribosomal Database Project (RDP) classifier将OUT代表序列与数据库对比进行物种注释(置信度阈值默认为 0.8 以上),得到每条序列从门到属各个水平的分类信息,基于分类学信息,可以在各个分类水平上进行群落结构的统计分析[24].利用 Mothur 软件统计每个生物样本的 Good’s coverage、ACE、Chao1、Shannon、 Simpson 等 alpha 多样性指数[25].使用 QIIME 软件计算 weighted UniFrac 距离,用于 beta 多样性的评估分析 [26].
1.4 水质与抗生素含量检测分析
COD 采用 HJ/T 399-2007(快速消解分光光度法) [27]测定,TN 采用 HJ636-2012(碱性过硫酸钾消解紫外分光光度法) [28]测定,NH4 + -N 采用 HJ 535-2009 (纳氏试剂分光光度法) [29].污水中抗生素含量的测定采用超高效液相色谱/串联质谱法(HPLC-MS),测定的抗生素有:磺胺甲恶唑(SMZ)、磺胺间甲氧嘧啶 (SMM)、环丙沙星(CIP)、恩诺沙星(ENR)、氧氟沙星(OFLX)、强力霉素(DOX)、四环素(TET)、土霉素(OTC)[30].
1.5 数据统计分析
运用 EXCEL 软件统计平均数和标准方差.采用 SPSS 软件对污水水质、抗生素含量、差异物种、多样性指数等进行单因素方差分析(LSD 法)和 Spearman 相关性分析.应用 R 软件统计细菌群落数据并绘制柱状图、热图、进化树、PCoA 图,同时运行相似度分析(Anosim)对样品组间差异显著性进行检测以及对环境因素和细菌群落结构进行冗余分析(RDA)、Pearson Correlation 相关性分析[31-32].通过 LEfSe 软件线性判别分析找出对样品划分产生显著性影响的差异物种[33].
2 结果与讨论
2.1 废水水质及抗生素含量动态变化
养殖污水净化处理过程中,水质动态变化见表 1.从表中可知,养殖废水有机物浓度较高,集污池中污水 COD 浓度高达 5180mg/L,经过厌氧反应器后,COD 浓度急剧降低,降至 1246mg/L,去除率达到 75.95%,而曝气池和氧化塘对 COD 的贡献率仅为 15.41%和 1.68%,最终 COD 出水浓度为 361mg/L.这与已有的多数研究结果基本一致[2-5],养殖废水中的有机物被厌氧微生物分解、代谢、消化,去除率可达到 65%~80%;但出水后的沼液具有低 COD/N 的特性,其有机质不易被微生物利用[34].在脱氮方面,养殖废水中的 TN 含量主要以 NH4 + -N 为主,TN 和 NH4 + -N 在厌氧反应器中的去除量不高,而在曝气池和氧化塘中被大量去除,去除率分别为 75.75%和 83.83%,出水 TN 浓度为 137.67mg/L,NH4 + -N 浓度为 63.67mg/L.有的研究认为曝气使自养型硝化细菌处于优势,可以稳定高效地转化 NH4 + -N 为 NO3 - -N[1].
在抗生素去除方面,本研究共检测了 2 种磺胺类、3 种氟喹诺酮类以及 3 种四环素类,这几种抗生素在猪场中被普遍使用且检出率较高[35-37].抗生素浓度在各处理单元的变化情况具体见表 2.总体上看, 除 TET 外,其他 7 种抗生素都具有明显的去除效果, 去除率达到 86.91%~100%.从表中可知,厌氧反应器对污水中 CIP、TET 没有明显的消减作用,对 ENR 的消减作用达到 89.76%,但 SMZ、SMM、OFX、 DOX、OTC 等均表现出负去除现象.分析认为,原因可能是固体颗粒中吸附的抗生素解吸到水相中[1,36]. 曝气池处理后,多种抗生素浓度大幅降低,SMZ、 SMM、CIP、DOX、OTC 浓度均显著(P<0.05)小于厌氧反应器中浓度,其中 CIP 浓度已经低于仪器检测下限.曝气池处理后的出水经过包含穗花狐尾藻和胡子鲶的氧化塘,各种抗生素浓度均得到进一步降低,SMZ 和 SMM 浓度低于仪器检测下限,ENR 和 OFX 浓度仅为 0.01µg/L 和 0.17µg/L.此外,养殖污水中四环素类抗生素 TET、DOX、OTC 经处理系统处理后,出水中的浓度仍较高,分别为 4.80µg/L、 5.77µg/L 和 2.30µg/L,这与多项研究结果大体相似 [38-39],表明处理系统对四环素类抗生素的降解能力较小.这可能与四环素类抗生素化学结构有关,其降解机制复杂、半衰期长,甚至在特定情况下降解产物还会转化为母体化合物;且四环素类抗生素是疏水性有机物,与其他抗生素相比,更容易被吸附在固体颗粒上而受到保护[40].
2.2 污水细菌群落结构特征与动态变化
如表 3 所示,12 个污水样品获得的有效 16S rRNA 序列数为 42537~69256 条,共计 608526 条.基于 97%的序列相似性,共获得 8508 个 OTUs,平均每个 样 品 为 2263 个 OTUs.OUT 覆 盖 率 (Good’s coverage)显示 97%以上的微生物被捕捉到,表明本研究获取的数据量能够很好地反映特定样品的细菌多样性情况.Alpha 多样性分析结果表明(表 3),不同处理单元出水中的微生物群落的丰富度指数 (ACE 和 Chaol)和多样性指数(Shannon 和 Simpson) 都存在一定的差异,上游处理单元的细菌物种数和群落多样性要比下游处理单元高,厌氧反应器中的细菌物种数和群落多样性要比有氧处理单元高.一般来说,细菌物种数和群落多样性越丰富,污染物的去除效果越好[41]. 利用 RDP classifier 对 97%相似度水平的 OTU 代表序列进行物种分类注释,共得到 31 个门水平的细菌和一些无法归类的细菌(图 2).从图 2 中可见,集污池中的污水优势菌为 Firmicutes、Bacteroidetes 和 Proteobacteria,分别占全部细菌总数的 41.47%、 30.52%和 24.07%;Lamendella 等[42]研究显示猪肠道微生物的主要类群为Firmicutes和Bacteroidetes,表明生猪养殖废水中的微生物主要以肠道微生物为主.在厌氧反应器中,优势群体的种类没有改变,但数量明显发生了变化,Firmicutes(62.99%)显著(P<0.05)高于集污池,而 Bacteroidetes(23.32%)和 Proteobacteria (5.15%)显著(P<0.05)低于集污池;在曝气池中,优势细菌变为 Firmicutes(35.33%) 、 Verrucomicrobia (12.94%) 、 Bacteroidetes(12.40%) 、 Proteobacteria (12.09%)和 Candidatus Saccharibacteria (8.28%),且各种群含量与厌氧反应器均存在显著差异(P<0.05);进入氧化塘后,优势群体的种类为 Firmicutes (37.39%)、 Proteobacteria(12.09%) 、 Chloroflexi (7.84%) 、 Euryarchaeota(6.12%) 和 Bacteroidetes (5.63%), 除 Firmicutes 和 Euryarchaeota,其他种群含量与曝气池均存在显著差异(P<0.05);说明不同的污水处理单元, 细菌的优势菌群具有明显差异.
通过高通量测序,在整个生猪养殖污水处理过程中共检测到 548 个属的细菌,对属水平的细菌群落数量在前 50 的属进行热图分析,结果见图 3.从样品间的属水平的聚类关系可以看出,污水中细菌种群有高达 20.30%~38.40%的物种未分类,且其种类及数量随着处理进程逐步发生改变.在集污池中,优势细菌属为 Acinetobacter(10.81%) 、 Bacteroides (9.25%)和 Prevotella(7.25%);进入厌氧反应器中,优势细菌属发生了明显的变化,变为 Terrisporobacter (9.80%) 和 Petrimonas(7.93%); 在曝气池中 , Petrimonas 含量显著降低(P<0.05), Saccharibacteria_ genera_incertae_sedis 和 Subdivision5_genera_ incertae_sedis 大 幅 增 长 (P<0.05), 优势菌 属 为 Saccharibacteria_genera_ incertae_sedis(7.80%) 、 Terrisporobacter(7.70%) 、 Subdivision5_genera_ incertae_sedis(7.50%), 进 入 氧 化 塘 后 ,Clostridium sensu stricto、Methanothrix 和 Oligotropha 显著增长 (P<0.05), 优势菌 属 为 Terrisporobacter(9.09%) 、 Clostridium sensu stricto (7.33%) 、 Methanothrix (6.11%)和 Oligotropha(5.43%). 2.3 组间群落结果差异分析
为比较污水各处理单元样品中细菌群落的差异性,根据各样本物种丰度计算 Beta 多样性距离矩阵,计算样本间距离的方法为 weighted Unifrac,样本间的距离越大,说明样本间的细菌群落差异越大.基于距离矩阵进行聚类分析可以发现(图 4a),细菌群落结构的变化是随着处理进程逐步发生改变的;基于距离矩阵进行 PCoA 发现(图 4b),前 3 个主坐标可以代表 90%的变量信息,并且各样品细菌群落随处理进程的变化过程主要是在 PCoA1 轴方向发生.曝气池和氧化塘样品的距离较近,表明这 2 个处理单元的微生物组成相似.
Anosim 分析结果可以看出各处理单元污水样品组间差异大于组内差异(R=1),并且具有显著的统计学差异(P=0.002<0.05),表明生猪养殖污水的各处理单元的群落结构发生了明显的变化(图 5).进一步通过 LEfSe 判别分析估算各物种类群对差异效果影响的大小,筛选出对样本分类有显著影响作用的物种,结果见图 6.从图中可以看出,集污池、厌氧反应器、曝气池和氧化塘对组间基因或功能差异有显著影响的物种类群分别为 45,17,29 以及 53 类.其中集污池与其他处理单元存在显著差异的菌群主要包括 Proteobacteria 中 的 Gammaproteobacteria 和 Bacteroidales 等 , 研 究 表 明 Proteobacteria 和 Bacteroidetes 均为畜禽养殖污水中的优势菌群, Proteobacteria 主 要 负 责 有机和 营 养物的去除 , Bacteroidetes 在污水中的作用仅次于 Proteobacteria[43-44]. 厌氧反应器中存在显著差异的门类为 Firmicutes 和 Spirochaetes,Ducey 等 [45] 研 究 表 明 , 包 含 产 酸 菌 Clostridiales、Clostridium、Acidobacteria 以及产甲烷菌的 Firmicutes 在厌氧处理阶段起着关键作用.Verrucomicrobia 是曝气池显著高于其他处理阶段的菌群门类,其是高效活性污泥中常见门类,主要用于对有机物的降解[46-47].在氧化塘中检测到众多与其他处理单元存在显著差异的菌群,主要隶属于 Proteobacteria、Planctomycetes、Euryarchaeota、 Deinococcus- Thermus、Chloroflexi 和 Actinobacteria, 这些差异菌群的存在可能与穗花狐尾藻根系微生物和胡子鲶肠道微生物有一定的关系.
2.4 细菌群落与水质环境因子之间的关系
水质环境因子影响着微生物的微生态生存环境,微生物的生长代谢反过来影响着水质中化学物质的存在形态和浓度[48-49].在属分类上对菌群(相对丰度>2%)进行 Pearson Correlation 相关性分析,结果如表 4 所示. 呈显著正相关,Clostridium sensu strict、Methanothrix 与 TN、NH4 + -N 呈显著负相关.在抗生素方面,磺胺类 SMZ、SMM 和四环素类 DOX、OTC 与菌群的相关性一致,均与 Petrimonas、Lachnospiracea_ incertae_sedis、Clostridium XlVa、Tissierella 呈极显著正相关;氟喹诺酮类 ENR 和四环素类 TET 与菌群的相关性相似,与 Acinetobacter、Bacteroides、 Prevotella 呈 显 著 正 相 关 ; 氟喹诺酮类 CIP 与 Prevotella、Lachnospiracea_incertae_sedis 呈显著正相关,而 OFLX 与菌群 Clostridium sensu stricto、 Petrimonas 呈显著正相关. 由上述分析结果可知,不同的外部环境因子对于生猪养殖净化系统中的微生物群落组成均有着显著的影响.因此,对于生猪养殖污水的处理,创造合理的生存条件,促进微生物特别是功能菌的增殖,最大程度发挥降解有机物和脱除氮的功能,可能是提高其处理效果的有效途径[2].
3 结论
3.1 本研究的生猪养殖污水净化处理系统中具有极其丰富的生物多样性,共检测得到 31 个门、548 个属的细菌.其中,集污池的优势种群为 Firmicutes (41.47%) 、 Bacteroidetes(30.52%) 和 Proteobacteria (24.07%); 厌 氧 反 应 器 优势群体为 Firmicutes (62.99%) 、 Bacteroidetes(23.32%) 和 Proteobacteria (5.15%);在曝气池中,优势细菌种群变为 Firmicutes (35.33%)、Verrucomicrobia(12.94%)、Bacteroidetes (12.40%) 、 Proteobacteria(12.09%) 和 Candidatus Saccharibacteria(8.28%);进入氧化塘后,优势群体的种类为 Firmicutes(37.39%)、Proteobacteria(12.09%)、 Chloroflexi(7.84%) 、 Euryarchaeota(6.12%) 和 Bacteroidetes(5.63%).
3.2 生猪养殖污水各处理单元中的细菌群落结构随处理进程逐步发生改变,并且存在显著的统计学差异(P<0.05).集污池、厌氧反应器、曝气池和氧化塘对各处理单元细菌基因或功能差异有显著影响的物种类群分别为 45,17,29 以及 53 类.其中集污池存 在 显 著 差异的菌群为 Proteobacteria 和 Bacteroidales,厌氧反应器中存在显著差异的门类为 Firmicutes和Spirochaetes,曝气池显著差异的门类为 Verrucomicrobia,而氧化塘中检测到众多与其他处理单元存在显著差异的菌群,隶属于 Proteobacteria、 Planctomycetes 、 Euryarchaeota 、 DeinococcusThermus、Chloroflexi 和 Actinobacteria.
3.3 本研究的生猪养殖污水中的细菌群落与水质环境因子之间 存 在 显 著 相 关 (P<0.05). 其 中 , Acinetobacter 、 Bacteroides 、 Prevotella 、 Lachnospiracea_incertae_sedis 与 COD、TN、NH4 + -N 呈显著正相关,Clostridium sensu strict、Methanothrix 与 TN、NH4 + -N 呈显著负相关.在抗生素方面,SMZ、 SMM、DOX、OTC 与 Petrimonas、Lachnospiracea_ incertae_sedis、Clostridium XlVa、Tissierella 呈极显著正相关,ENR、TET 与 Acinetobacter、Bacteroides、 Prevotella 呈 显 著 正 相 关 ,CIP 与 Prevotella 、 Lachnospiracea_incertae_sedis 呈显著正相关,OFLX 与菌群 Clostridium sensu stricto、Petrimonas 呈显著正相关.
参考文献:
[1] 庄榆佳,高阳俊,邓玉君,等.微生物固化曝气技术对养殖废水的深度处理 [J]. 环境化学, 2015,34(7):1356-1362. Zhuang Yu-jia, Gao Yang-jun, Deng Yu-jun, et al.Advanced treatment of swine wastewater by the immobilized-microorganism and aeration technology [J]. Environmental Chemistry, 2015,34(7):1356-1362.
[2] 翟一帆,袁青彬,胡 南.养猪废水处理系统微生物群落结构变化及影响因素研究 [J]. 水资源保护, 2018,34(1):88-94. Zhai Yi-fan, Yuan Qing-bin, Hu Nan. Study on structure variation and influencing factors of microbial community in swine wastewater treatment system [J]. Water Resources Protection, 2018,34(1):88-94.
[3] 申童童,袁林江,温丹丹,等.侧流污泥返送到缺氧池对 A2 /O 系统效能影响研究 [J]. 中国环境科学, 2018,38(9):3335-3342. Shen Tong-tong, Yuan Lin-jiang, Wen Dan-dan, et al. Effect of sidestream sludge returning to anoxic tank on A2 /Osystem effectiveness [J]. China Environmental Science, 2018,38(9):3335-3342.
养殖废水处理系统中微生物菌群结构及动态变化相关论文期刊你还可以了解:《水产养殖废水净化与循环应用技术》
转载请注明来自:http://www.lunwencheng.com/lunwen/nye/14732.html