[摘要]目的:评估贻贝黏蛋白(MAP)注射入小鼠体内时的免疫原性,并为其临床应用提供安全性依据。方法:选择BALB/c小鼠72只,采用随机数表法将小鼠分为试验样品组(S组)、阴性对照组(N组)、阳性对照组(P组)、阳性抑制组(D组)、阳性促进组(P*组)及空白对照组(C组)6组,每组小鼠根据不同实验选取不同数量。通过免疫学实验评估MAP对小鼠免疫系统的影响,对T淋巴细胞转化功能、巨噬细胞吞噬功能、体液免疫应答、体重和脏器系数以及血液学和脾淋巴细胞总数对免疫器官组织学的影响进行评估。结果:注射高剂量MAP时,小鼠产生免疫应答;但S组与N组比较,临床等效剂量MAP产生的免疫原性未产生显著差别。S组与N组对淋巴细胞表面CD4、CD8和CD3、CD19标志的表达差异无统计学意义(t=0.171,t=0.995,t=0.240,t=0.163;P>0.05);MAP对小鼠腹腔巨噬细胞吞噬鸡红细胞的能力无明显的促进或抑制作用,S组与N组之间的差异无统计学意义(t=1.14,P>0.05)。MAP对小鼠的体液免疫应答和免疫因子水平、小鼠的体重和免疫器官(胸腺和脾脏)和小鼠的白细胞计数未产生显著影响,且未表现出刺激小鼠脾淋巴细胞增长的迹象,S组脾淋巴细胞总数虽低于N组,但差异无统计学意义(t=1.85,P>0.05)。结论:临床等效剂量MAP对BALB/c小鼠的体液免疫和细胞免疫未产生影响,应用于小鼠时安全性良好。
[关键词]贻贝黏蛋白(MAP);免疫原性;安全性;小鼠
当前,生物医用材料在临床需求和科技创新的双重驱动下取得了巨大的进步,一个典型的低能耗、低环境污染以及高技术附加值的新兴产业已经形成并将持续增长。贻贝黏蛋白(musseladhesiveprotein,MAP)是新型动物源性生物医用材料,是以十肽为基础单元聚合而成的大分子蛋白[1]。MAP来源于天然海洋贻贝,生物相容性好,可以作为粘合剂和新型生物创面敷料应用于临床,未来还有望作为新型组织工程支架或医疗器械涂层材料等[2-5]。
MAP的分子结构中含有20%的酪氨酸,带有大量正电荷,可与带负电荷的人体组织和细胞紧密结合;含有10%的3,4-二羟基苯丙氨酸(3,4-DihydroxyphenylL-Alanine,DOPA),具有持续抗氧化活性;除此之外,还含有疏水基团,可实现隔水附着,耐受液体冲刷[6-7]。MAP在骨科、口腔科及烧伤科中的应用广泛,具有创面保护、镇痛止痒和促进愈合等疗效[8-11]。MAP属于大分子蛋白质,当其作为异源物质进入机体时,具有刺激机体产生免疫应答的潜在风险,因此需对MAP的体内免疫原性进行研究。
目前,国内外还未见阐明MAP免疫原性的研究报道,免疫原性的不确定性给MAP相关产品在临床上的使用造成了阻碍,不利于产业的健康发展。本研究的前期研究数据(未发表)表明,将MAP溶液和MAP包被的人工骨颗粒分别注射于小鼠皮下,两种形态的MAP均可引发与相同剂量的鸡卵清白蛋白相当的免疫反应,反应强度约为鸡卵清白蛋白和佐剂组的1/10。由于该实验使用的剂量为MAP临床等效剂量的100倍以上,因此本研究对临床等效剂量MAP的免疫原性进行深入的研究,以观察其对机体是否造成影响。
1材料与方法
1.1实验动物
选用BALB/c小鼠72只,无特定病原体级,6~8周龄,雌雄各半,体质量为15.1~28.4g,购自成都达硕实验动物有限公司[SCXK(川)2014-028]和北京维通利华实验动物技术有限公司[SCXK(京)2016-0011)]。每日供应小鼠啮齿动物饲料[许可证号为SCXK(京)2014-0010],并由自动供水系统提供饮用水,饲养室控制温度为19~23℃,相对湿度为45%~65%。小鼠提前适应环境5d,并观察一般状况,仅健康无异常的方可进入研究。采用随机数表法分为试验样品(studygroup,S)组、阴性对照(negativegroup,N)组、阳性对照(positivegroup,P)组、阳性抑制(dexamethasone,D)组、阳性促进(positivegroup*,P*)组及空白对照(blankcontrol,C)组6组。根据不同实验从72只小鼠中选取不同数量的小鼠。实验开始时,每只小鼠的体重均不超过同性别小鼠平均体重的±20%。
1.2仪器设备与试剂
(1)仪器设备。FACSCantoII型流式细胞仪(美国Becton,Dickinson公司);MultiskanFC型酶标仪(美国ThermoFisherScientific公司);SQP型电子天平(中国赛多利斯科学仪器(北京)有限公司);OlympusBX53型光学显微镜(日本Olympus公司)。
(2)试剂。胎牛血清(fetalcalfserum,FCS)细胞盒(香港cell-box公司);RPMI640培养液(美国HyClone公司);羧基荧光素乙酰乙酸(carboxyfluoresceinsuccinimidylaminoester,CFSE)(中国上海晶纯生化科技股份有限公司);刀豆蛋白A(ConA)(美国Merck公司);单克隆抗体(美国Becton,DickinsonandCompany公司);二甲基亚砜(dimethylsulfoxide,DMSO)(美国Merck公司);噻唑蓝(美国Merck公司);完全弗氏佐剂(美国Merck公司);1%鸡红细胞(浙江玉环县南方试剂厂);1%绵羊血红细胞(浙江玉环县南方试剂厂)。
(3)供试品。MAP创面修复敷料(0.5mg/ml,×5ml)由江阴贝瑞森生化技术有限公司提供(2017-09576)。
1.3实验方法
参考国家标准[12-15]及相关文献[16]的建议选择BALB/c小鼠作为研究种属,探索临床等效剂量MAP的免疫原性。MAP临床最大使用剂量为5~10mg(临床使用周期为4~6周),通过体表面积折算的小鼠等效剂量为0.015~0.030mg/只。本研究中采用的小鼠等效剂量为0.030mg/只。免疫学评价放大倍数为50倍临床使用剂量。
1.3.1动物免疫实验
对6组小鼠处理方法如下。①S组:每只小鼠背部皮下注射试验样品,注射总剂量为3.0ml,每10d注射1次,每次1.0ml/只,共注射3次;②N组:不注射试验样品,同S组操作于小鼠背部皮下注射生理盐水;③P组:不注射试验样品,皮下注射牛血清蛋白(bovineserumalbumin,BSA)与完全弗氏佐剂(completeFreund'sadjuvant,CFA)等体积混合的乳剂,BSA终浓度为1mg/ml,0.1ml/只,每2周注射1次,共注射2次,其他处理同S组;④D组:不注射试验样品,免疫30d后腹腔注射5mg/kg地塞米松,0.2ml/只(0.5mg/ml);⑤P*组:不注射试验样品,免疫30d后腹腔注射10mg/kg植物血凝集素A,0.2ml/只(1mg/ml);⑥C组:不作任何处理。
1.3.2CFSE法
参照国家标准《医疗器械免疫原性评价方法体外T淋巴细胞转化试验》(YY/T1465.1-2016)[12]评估对T淋巴细胞转化功能的影响。从72只小鼠中选取12只,其中S组6只,N组6只,30d免疫周期结束后,脱颈椎处死小鼠,无菌取脾研磨制备单细胞悬液。以市售荧光标记抗体标记后行流式细胞分析术检测T淋巴细胞的免疫表型。
免疫期结束后,脱颈椎处死各组小鼠,无菌取脾,分别研磨制备成单细胞悬液,收集细胞悬液,以1000r/min(400×g)离心5min,弃上清,加入5ml红细胞裂解液,混匀,37℃孵育5min,以1000r/min(400×g)离心5min,弃上清,加入10%FCS的RPMI640培养液,调整细胞浓度至2×106个/ml。将上述淋巴细胞悬液用PBS至少洗2次,弃上清,用2mlPBS重悬细胞,分别加入CFSE,终浓度为2.5μmol/L,混匀,37℃避光孵育20min,加入3ml冰冷的含2%FCS的RPMI1640培养液终止染色反应,轻轻混匀,以1000r/min(400×g)离心5min,弃上清,加入含10%FCS的PRMI1640培养液3ml,混匀。
各组细胞悬液加入24孔板,500μl/孔,每组设2个复孔。试验平板在37℃、5%二氧化碳(CO2)培养箱中孵育,培养第3天,各孔加入500μl相应的培养液,S组、N组加入相应的刀豆蛋白A(ConA)分别为S组-刺激和N组-刺激,终浓度为5μg/ml,继续培养3d。收集各孔细胞,用荧光素(phycoerythrin,PE)标记的抗小鼠分化簇3(CD3)单克隆抗体染色,在4℃避光条件下孵育30min,应用流式细胞术进行分析。
1.3.3噻唑蓝比色法
将CFSE法获得的淋巴细胞悬液加入96孔板,每孔200μl,设5个复孔。S组-刺激和N组-刺激加入ConA使终浓度达到5μg/ml。试验平板在37℃、5%CO2培养箱中培养至少3d后取出,400×g离心5min,弃100μl上清,加入噻唑蓝(1mg/ml),50μl/孔。继续培养6h后取出,400×g离心5min,弃上清,加入DMSO,200μl/孔,振荡平板至甲臜颗粒完全溶解,在酶标仪上于570nm波长处测量吸光度值(A570)。
1.3.4半体内法
参照《医疗器械免疫原性评价方法小鼠腹腔巨噬细胞吞噬鸡血红细胞试验半体内法》(YY/T1465.4-2017)[13]。从72只小鼠中选取24只小鼠,其中S组6只,N组6只,D组6只,P*组6只,在免疫第8d时每只小鼠腹腔注射鸡红细胞悬液0.5ml。30d免疫结束后,镜下计数巨噬细胞,每张片计数200个,按下式计算吞噬百分率。吞噬百分率(%)=吞噬鸡红细胞的巨噬细胞数÷计数的巨噬细胞总数×100%。评估对巨噬细胞吞噬能力的影响。
1.3.5酶联免疫吸附法
参照《医疗器械免疫原性评价方法血清免疫球蛋白和补体成分测定(ELISA法)》(YY/T1465.2-2016)[14]。从72只小鼠中选取30只,其中S组10只,N组10只,P组10只。免疫结束后眼眶采血,收集于1.5ml离心管中,4℃放置2h,1000×g(4000r/m)离心10min,收集上层血清,按照检测试剂盒的步骤处理样本后放入酶标仪进行免疫指标(测定血清中补体(C3a和C5a)、免疫球蛋白(IgG和IgM)和免疫因子白细胞介素(interleukin,IL)-1b、IL-2和肿瘤坏死因子α(tumornecrosisfactor-α,TNF-ɑ)水平)的检测。称量记录小鼠终点体重。脱颈椎处死小鼠,分离除去周围的结缔组织和脂肪组织,使用滤纸吸干脏器表面的血液,称量脾和胸腺重量。
1.3.6琼脂固相法
参照《医疗器械免疫原性评价方法空斑形成细胞测定琼脂固相法》(YY/T1465.3-2016)[15]。从72只小鼠中选取24只,其中S组6只,N组6只,D组6只,C组6只。30d免疫结束后,各组小鼠腹腔注射1%绵羊血红细胞(sheepredbloodcell,SRBC)悬液,0.2ml/只。注射后第4d处死动物。处死后立即取脾脏,置于无血清的培养基中,剪碎后过滤制备脾细胞悬液。将绵羊血红细胞悬液与脾细胞迅速混合后倒入平皿中(每只动物3个平行样本),凝固后放入培养箱孵育1.5h,孵育完成后,计数溶血空斑数。
1.3.7脾脏淋巴细胞总数
从72只小鼠中选取12只小鼠,其中S组6只,N组6只,经过30d免疫后,眼眶采血,血样用于检测血液学指标,包括白细胞、红细胞、血小板、平均红细胞体积、平均红细胞血红蛋白含量、平均红细胞血红蛋白浓度、淋巴细胞百分率、单核细胞百分率、中性粒细胞百分率、血红蛋白和红细胞压积。然后脱颈椎处死小鼠,取脾脏研磨制备成单细胞悬液,收集细胞悬液后经离心,裂解红细胞,孵育,再离心,加反应中止液调整至适宜浓度后计数细胞,计算整个脾脏的淋巴细胞总数。
1.3.8组织学观察法
从72只小鼠中选取40只小鼠,其中S组20只,N组20只,分别经过2个免疫周期(4周和12周)的免疫,每周期20只小鼠。每一观察期,脱颈椎处死小鼠,沿脊柱作纵向切口,打开皮肤充分暴露注射部位,取此部位及其周围组织;免疫第4周取小鼠的脾脏和胸腺。样本置于10%福尔马林内固定,然后置于梯度酒精内脱水,经石蜡包埋,切片后采用苏木精-伊红(HE)染色,观察组织学改变。
1.4统计学方法
采用SPSS软件进行统计学分析,计量资料用均数±标准差(x-±s)表示,采用独立样本t检验;计数资料以百分率(%)表示,采用x2检验,以P<0.05为差异有统计学意义。
2结果
2.1对细胞免疫应答的影响
2.1.1T淋巴细胞转化功能
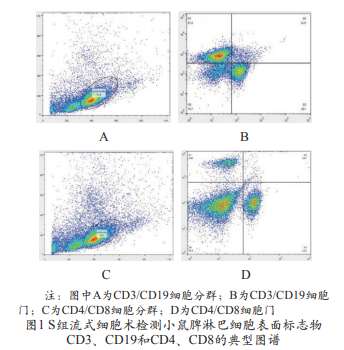
S组和N组小鼠脾淋巴细胞表面标志物CD3、CD19和CD4、CD8的表达典型图谱见图1。
经过30d免疫后,与N组比较,S组小鼠脾淋巴细胞表面标志物CD4、CD8和CD3、CD19的表达差异均无统计学意义(t=0.171,t=0.995,t=0.240,t=0.163;P>0.05),见图2。
经ConA刺激后,各组小鼠出现了明显的增殖反应,表示受试细胞产生正常的免疫反应。N组和S组的非刺激与刺激小鼠T淋巴细胞转化增殖光密度(opticaldensity,OD)值之间的差异有统计学意义(t=2.00,P<0.01)。但是加入MAP后,S组-非刺激与对应N组非刺激之间差异无统计学意义(t=0.900,P>0.05),S组-刺激与N组-刺激的OD值之间差异无统计学意义(t=2.54,P>0.05)。以上结果提示试验样品MAP在30d免疫过程中或者与浸提液接触过程中未表现出对小鼠T淋巴细胞免疫功能的影响,见图3。
2.1.2巨噬细胞吞噬功能
S组、N组、D组和P*组的吞噬百分率分别为37.6%、39.4%、31.4%和49.9%。对S组、N组、D组及P*组的吞噬百分率进行t检验,结果显示:S组与D组、P*组之间的差异有统计学意义(t=2.59,t=6.32;P<0.05),N组与D组、P*组之间的差异有统计学意义(t=2.22,t=6.32;P<0.05),S组与N组之间的差异无统计学意义(t=1.14,P>0.05)。
相关知识推荐:动物检疫论文发表难度大吗
2.2体液免疫应答的影响
2.2.1补体、免疫球蛋白和免疫因子水平
将检测得到的C3a、C5a、IgG、IgM、IL-1b、IL-2和TNF-ɑ浓度分别进行等方差t检验,结果表明:S组与N组的差异无统计学意义(t=1.30,P>0.05),S组与P组的差异有统计学意义(t=2.80,P<0.05),同时N组与P组之间的差异有统计学意义(t=0.693,P<0.05),见图4。
2.2.2空斑形成
S组、N组、C组和D组的空斑数分别为188×106个、198×106个、2×106个和63×106个。对S组、N组、C组、D组的空斑数进行t检验,结果显示:S组与C组、D组之间的差异均有统计学意义(t=6.78,t=3.46;P<0.05),N组与C组、D组之间的差异均有统计学意义(t=6.20,t=3.12;P<0.05),S组与N组之间的差异无统计学意义(t=0.197,P>0.05)。
2.3对小鼠体重和脏器系数的影响
对各组的小鼠体重、胸腺和脾脏质量以及胸腺/体重比值、脾脏/体重比值进行等方差t检验,结果显示:免疫前后S组、N组及P组3组小鼠的体重和免疫后3组小鼠的胸腺/体重比值的差异均无统计学意义(t=5.16,P>0.05);与P组比较,S组小鼠的胸腺质量、脾脏质量和脾脏/体重比值的差异均有统计学意义(t=2.77,t=9.10,t=5.06;P<0.05);N组与P组之间的差异均有统计学意义(t=2.40,t=4.42,t=3.27;P<0.05);但是S组胸腺质量、脾脏质量和脾脏/体重比与N组之间的差异均无统计学意义(t=0,t=0.681,t=0.602;P>0.05),见图5。
2.4血液学和脾淋巴细胞总数的影响
将S组和N组的血液学指标数据进行t检验,结果显示:S组除血红蛋白、红细胞压积略低于N组,且差异均有统计学意义(t=2.05,t=2.01;P<0.05)外,白细胞、红细胞、血小板、平均红细胞体积、平均红细胞血红蛋白含量、平均红细胞血红蛋白浓度、淋巴细胞百分率、单核细胞百分率和中性粒细胞百分率指标的差异均无统计学意义(t=1.72,t=1.25,t=1.27,t=1.32,t=0.930,t=1.70,t=1.04,t=1.17,t=0.854;P>0.05);S组脾淋巴细胞总数虽低于N组,但差异无统计学意义(t=1.85,P>0.05),见图6。
2.5免疫器官组织学的影响
免疫4周后,肉眼观察,S组和N组小鼠脾脏和胸腺无水肿和出血改变;显微镜下观察,S组和N组小鼠注:①图中A为3组的补体因子C5a和C3a浓度水平对比,B为3组IgG和IgM免疫球蛋白浓度水平对比,C为3组TNF-α肿瘤坏死因子α浓度水平对比,D为3组白介素-2(IL-2)和白介素1-b(IL1-b)浓度水平对比;②S组为试验样品组,N组为阴性对照组,P组为阳性对照组图4经贻贝黏蛋白30d免疫后小鼠血清中免疫因子、补体和免疫球蛋白的浓度ABCD脾脏结构清晰,生发小结构正常,无出血点,胸腺各小叶结构完整,无出血现象,无变性坏死。免疫12周后,肉眼观察,S组和N组小鼠注射部位均无发红、水肿、出血等改变,S组小鼠注射部位的炎症较免疫后第4周减轻,偶见淋巴细胞、粒细胞和巨噬细胞,无明显炎症反应。典型的组织病理学图片见图7和图8。
3讨论
本研究考察了MAP皮下注射30d免疫期后的小鼠,免疫器官重量、免疫器官组织学变化、脾脏组织淋巴细胞总数、淋巴细胞表型分析等非功能性测试指标,T淋巴细胞转化、巨噬细胞吞噬功能、绵羊红细胞空斑形成试验、血清补体成分、免疫球蛋白水平等细胞免疫及体液免疫应答的功能性研究,以及血液白细胞分类、血清相关免疫因子水平、植入后局部免疫反应等炎症指标。本研究结果表明,试验样品MAP对小鼠腹腔巨噬细胞吞噬鸡红细胞的能力无明显的促进或抑制作用。经过30d免疫后,试验样品MAP对于小鼠的体液免疫应答、免疫因子水平均未产生明显影响,对小鼠的体重和免疫器官(胸腺和脾脏)也均未造成明显的影响。经过30d免疫后,试验样品MAP对小鼠的白细胞计数未产生显著影响,也未表现出刺激小鼠脾淋巴细胞增长的迹象。
本研究结果显示,MAP产生的免疫原性与阴性对照比较未产生显著性差别。表明MAP用于机体后对免疫器官和免疫功能无明显影响。
4结论
MAP是来源于海洋贻贝的一种大分子蛋白质,作为新型医用生物材料,已经作为Ⅱ类医疗器械在临床实践中广泛应用,未来有可能作为Ⅲ类医疗器械、组织工程材料涂层等植入人体内使用,对其安全性有更高的要求。本研究实验结果对MAP的免疫原性进行了系统研究,为MAP更广阔的应用提供了依据。——论文作者:焦菲菲①谢月①康瑞娟①*马立翠②董谦②母瑞红②*
转载请注明来自:http://www.lunwencheng.com/lunwen/nye/20686.html