摘要:三角梅(Bougainvilleaspectabiliswind)是一种在热带、亚热带地区广泛分布的观赏性藤本状灌木.选 取 同 安 红三角梅品种(MissManila)为研究对象,测定其在成花早期组织器官形态变化过程中19种内源激素或激素前体的动态变化,并开展激素之间的相关性分析和互作网络化分析.结 果 显 示:赤 霉 素4(GA4)、GA7、顺 式-12-氧-植 物 二 烯 酸(cis-OPDA)、脱落酸(ABA)、反式玉米素(tZ)、反式玉米素核苷(tzR)、油菜素甾酮(CS)和1-氨基环丙烷羧酸(ACC)等激素或前体水平都在三角梅花芽分化初期有大幅度的提升.其 中,GA7的水平在未分化期→花 芽 分 化 初 期(刺→花 刺)升 高 了1388%,并在花芽分化的不同时期都保持较高水平,说明高水平的 GA7对三角梅成花具有促进作用.进一 步 分 析 表 明,高浓度的 ABA、tzR和 ACC只特异性在三角梅侧端成花中显著高表达,二氢玉米素(DHZ)和水杨酸(SA)则特异地参与三角梅顶端成花的分化;这些激素可能应用于三角梅的选择性开花调控.综上可见 GA7、cis-OPDA、GA4和tZ可能作为节点激素在三角梅开花早期扮演着关键调控角色,可为深入理解三角梅开花的分子机制以及在生产实践中实现三角梅的精准花期调控提供参考.
关键词:三角梅;植物激素;花芽分化
三 角 梅(Bougainvilleaspectabilis wind)隶 属 被子植物(Angiosperms)真 双 子 叶 植 物(Eudicots)石 竹目(Caryophyllales)紫 茉 莉 科(Nyctaginaceae)叶 子 花属(Bougainvillea)攀援型灌木,作为一种热带和亚热带常见的观 赏 植 物,在 世 界 各 地 被 广 泛 种 植[1].在 生产实践中,养护技术人员希望能够精准调控三角梅在特定的时间节点开花并延长花期,但迄今国内外对三角梅开花机制的了解较为有限.
三角梅成花过程具备被子植物开花的共性,即花芽分化表征被子植物由营养生长转向生殖生长[2-4].目前对于三 角 梅 成 花 过 程 的 具 体 分 期 国 内 外 并 未 有一致的结论.在前期研究中,邱胤晖[5]和田高飞[5-6]根据各阶段花芽形态分化的特征,将三角梅的开花过程分为7个时期,即未分化期、分化初期、苞片原基分化期、小花原基分化期、花瓣原基分化期、雄蕊原基分化期和雌蕊原基分化期.而聂艳等[7]根据对三角梅花芽的解 剖 结 果,将花芽分化过程分为未分化期、花 序 原基形成期、苞片原基形成期、小花原基形成期、萼片原基形成 期、花 瓣 原 基 形 成 期、雌雄蕊原基形成期7个时期[7].Lopez等[8]对 三 角 梅 的 花 序 结 构 以 及 成 花 过程进行了形态学的分类描述,将三角梅花的生命周期分为未命名 的5个 阶 段.Hackett等[9]则 通 过 对 三 角梅的花序原 体 解 剖 来 阐 述 三 角 梅 花 芽 分 化 过 程 中 的形态 变 化,并以芽的形状和大小为特征,将 花 序 的 发育分为13个花芽发育阶段和3个花期阶段.
在三角梅的成花分子机制方面,国内外已经开展了一些研究.多数工作以拟南芥(Arabidopsisthaliana)为参考,发现一些已知被子植物成花相关基因在三角梅中的 同 源 基 因,包 括 APETALA1(AP1)、LEAFY(LFY)、CONSTANS (CO)和 类 黄 酮-3′-羟 化 酶(F3H)等[5];但 整 体 而 言,三角梅的成花研究还处于初级 阶 段.一 方 面,许多已知被子植物成花相关基 因还未在三角梅中被阐明;另 一 方 面,已 知 成 花 基 因 未能被很好地关联起来,以系统阐明三角梅的成花分子机制.此外,内 源 性 植 物 激 素,如 脱 落 酸(ABA)、赤 霉素(GA)和吲哚乙酸(IAA)等,在植物的开花过程中也发挥着重要作用.它们在植物体内的平衡状况是植物营养生长和生殖生长的基 础,也是开花的诱导条件.通过调节这些植物激素的平衡状态,可以实现植物营养生 长 和 生 殖 生 长 的 转 换[10-11].陈 庭 巧 等[12]和 聂艳[13]研究发现,外源植物激素或植物生长调节剂可引起植株原有内源激素相对比例的改变,干扰植物内源激素 的 稳 态 平 衡,从 而 达 到 调 控 开 花 的 目 的.在 生 产实践 中,通 过 单 一 或 组 合 喷 洒 GA、ABA 和 矮 壮 素(CCC)等化 学 手 段 可 在 一 定 程 度 上 实 现 对 三 角 梅 的花期调控[14-15];但 由 于 缺 乏 对 三 角 梅 成 花 机 制,尤 其是成花早期各激素表达情况的深入了解,化学干预三角梅开花的效率不高,甚至出现反效果[16].因此,本研究拟跟踪三 角 梅 顶 端 和 侧 端 成 花 过 程 中 多 种 常 见 植物激素的变化情况,发掘可能参与三角梅成花过程的植物激素,并分析能特异促进三角梅顶端和侧端成花的激素组合,以期为将来生产实践中精准调控三角梅成花提供科学参考.
1 材料与方法
1.1 生物样本的采集与预处理
本研究选取 三 角 梅 品 种 同 安 红(MissManila)作为研究对象.样本采集时间为2018年10月,处于正常花期;采样地点为厦门万银环境科技有限公司三角梅栽培基地.为了消除植株批次、生长养护环境、植物个体及采样部位差异所导致的激素水平差异,选取同一生长批次的4株4年生盆栽三角梅,在同一时间段内采集不同植株、不同枝杈的样品.参考既往研究,根据花芽分化各阶段的形态学和解剖学特征,将三角梅成花早期分为以 下3个 阶 段:未 分 化 期(刺 或 叶 芽)、分化初期(花刺或花芽)和分化后期(小花苞).采集的组织器官样本按照采集部位分为3组:以非开花部位小叶作为对照组;侧端开花组系经叶腋处侧端的刺发育开花,包括刺、花刺和小花苞;顶端开花组系顶芽发育开花,包括叶芽、花芽和小花苞.由于独立样本较小难以直接开展可靠的激素测定,将同一形态时期采集的样本混合,并随机分 为2个 生 物 学 重复.样本采集后,在现场用双蒸水(ddH2O)充 分 冲 洗 样 本,经 干 净 滤 纸充分干燥后,立即用锡箔纸包裹标记,液氮冻存.
1.2 植物激素测定
1.2.1 标准曲线
测定生物样本中19种常见植物内源激素及其合成前 体 的 水 平,包 括 GA1、GA3、GA4、GA7、茉 莉 酸(JA)、异亮氨酸化茉莉酸(JA-Ile)、顺式12-氧-植物二烯酸 (cis-OPDA)、ABA、水 杨 酸 (SA)、反 式 玉 米 素(tZ)、二氢玉 米 素(DHZ)、反式玉米素核苷(tzR)、异戊烯基腺嘌呤核苷(iPR)、异戊烯基腺嘌呤(iP)、油菜素内酯(BL)、油菜素甾酮(CS)、香 蒲 甾 醇(TY)、1-氨基-环丙烷羧酸(ACC)和IAA.将19种激素的标准品溶于 甲 醇 水 溶 液(Merck公 司,144282),并 稀 释 为 系列浓度的标准工作溶液,采用同位素内标法建立标准曲线.所有标准品均购自 Olchemim 公司.
1.2.2 代谢物提取
将样品于液氮中研磨成 粉 末,称 取(80±3)mg,置于2mL离心管中,加入50μL内标溶液,加入1mL含1%(体 积 分 数)甲 酸 (Fluka公 司,06450)的 乙 腈(Merck公司,1499230-935),震 荡 混 匀2min;4 ℃避光抽提12h,14000g离心10min,取上清液800μL,氮气吹干;用100μL 乙 腈 水 溶 液(乙腈与水的体积比1:1)复溶,14000g离 心10min,取 上 清 通 过 液相色 谱-质 谱 (LC-MS)联 用 进 行 植 物 激 素 的 测 定分析.
1.2.3 LC-MS联用测定
待测样本首先 采 用 WatersⅠ-Class超 高 效 液 相色谱系统进行物质分离.分离流动相的 A 液为0.05%(体积分数)甲酸水溶液,B液为0.05%(体积分数)甲酸乙腈溶液.样品置于4 ℃自动进样器中,柱温45 ℃,流速400μL/min,进 样 量 2μL.相关的液相梯度如下:0~10.0min,B液从2%(体积分数,下同)线性变化至98%;10.0~11.1min,B 液从98%线性变化至2%;11.1~13.0min,B液维持在2%.分离样本接着采用5500QTRAP质谱仪(ABSCIEX 公司)在正/负离子模式下进行质谱分析.5500QTRAP电喷雾离子源条件如下:源温度 500 ℃,离子源气体1(Gas1)45,离子源气体2(Gas2)45,幕 帘 气 体(CUR)30,离 子 喷雾电 压 (ISVF)-4500 V;采 用 质 谱 多 反 应 监 测(MRM)技术测定离子对.
1.2.4 样本分析
将所 有 激 素 标 准 样 等 量 混 合 制 备 成 为 质 控(QC)样本.在待测 生 物 样 本 队 列 中 每 间 隔 一 定 数 量的实验样本设置一个 QC样本,用于检测和评价系统的稳定性和 重 复 性.混 合 样 本 队 按 标 准 操 作 流 程 通过 LC-MS联用 测 定 激 素 水 平.3 次 重 复 测 定 QC 样本各激素水平的相对标准方差(RSD)均<30%,说明实 验 数 据 稳 定 可 靠.样 本 激 素 测 定 结 果 采 用Multiquant软件提取色谱峰面积及保留时间,并根据标准曲线计算样品中植物激素水平.对两次生物学重复样本的各激素水平进行单因素方差分析,结果显示两次重复样间不存在显著差异(H0假设,p>0.1).因此,采用两次重复样的检测均值作为各形态时期样本的激素水平值.
1.3 激素水平变异系数和相关性分析
1.3.1 激素水平变异系数计算
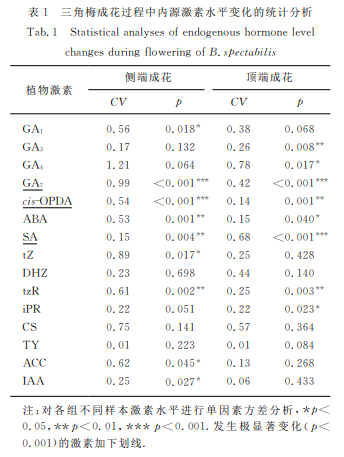
基于顶端和侧端两个成花路径样本组中19种内源激素水平的变化情况,对测得的激素含量取5为底的对数进行归一化处理,采用热图的形式衡量激素在成花过程中的变化趋势.同 时,为 了 消 除 不 同 激 素 含量本 底 水 平 不 同 带 来 的 影 响,不直接使用标准差(SD),而通过计算变异系数(CV)来 衡 量 开 花 样 本 组内激素水平在三角梅成花不同阶段的差异程度.CV=SD/平均值.CV 值越接近于0,表明激素在 不 同 时 期的水平差异越小;反之,则表明水平差异越大.通常情况下,CV>0.15即被认为水平差异较大[17].本研究以CV>0.3为标准判断变化显著的激素,同时采用 R 语言包的aov函数对每个样本组各激素在不同组织中的水平变化进行单因素方差分析.
1.3.2 激素水平变化间的相关性
分析根据三角梅在成花过程中的激素含量,采用 R 语言包的corrplot包分别分析三角梅顶端成花和侧端成花中各激素水平变化间的相关性.网 络 图 能 够 简 洁、直观地反映出激素之间的相互作用关系,特别是能够通过自身的拓扑结构突显出某些核心的关键激素.因此,采用 Cytoscape软件,选取相关系数大于0.6的激素构建激素间相互作用网络;进而通过 CytoHubba工具(Method:MNC)找出节点激素,并将激素按总关联度大小进行排序.
2 结果与分析
2.1 三角梅成花过程激素水平的整体变化
如图1所示,19种植物内源激素的含量水平在所有样本中整体呈阶梯状分布,其中,cis-OPDA、SA 和GA7的水平较其他激素高约2个数量级(102).如表1所示:在成花组织 中,尤 其 是 侧 端 成 花 路 径 中,上 述3种激素水平发生显著变化(CV>0.3,p<0.05),提示它们在成花中 可 能 发 挥 重 要 作 用;与 之 相 对,BL、iP、JA 和JA-Ile(表中未列出)在所有 样 本 中 均 稳 定 处 于低水平(在 LC-MS中检测均低于1ng/g),且在各 成花过程未发生显著水平变化(CV<0.1,p>0.05),提示这4种激素对三角梅成花无明显调控作用;其余的12种激素整体处于相对较低的水平,除 TY 在成花过程中保持基本水平稳定外(CV<0.1),多数激素或前体在成花的不同阶段均发生显著变化.在 侧 端 成 花中,水平差异较大(CV>0.3)的激素包括 GA7、GA4、tZ、GA1、CS、ACC、tzR、ABA 和cis-OPDA;在顶 端 成花中,水 平 差 异 较 大 的 激 素 包 括 GA4、GA7、DHZ、SA、CS和 GA1.值 得 一 提 的 是,虽 然cis-OPDA 在 顶端成花中CV 值仅0.14(表1),但是其在各组织中的水平较其他激素普遍高约2个数量 级(图1),且 在 花芽分 化(叶 芽→花 芽)过程中水平升高约 30%(见 后文),因此也将cis-OPDA 作为水平差异较大的激素纳入后续激素相互作用的分析中.
2.2 与三角梅成花关联的激素变化
分析三角梅成花不同阶段内源激素的变化趋势,如表2所示:在侧端成花中,水平差异较大的9种激素除 GA1外,在刺→花刺分化阶段均显示为上升的变化趋势,其中tZ的上升幅度最大,达1705%;在花刺→ 小花苞的阶段,GA1、GA4、GA7、cis-OPDA 和tZ略有下降,其他激素则没有明显变化.在顶端成花中,水平差异较大的6种激素变化差异明显.在叶芽→花芽分化阶段,GA7、cis-OPDA、DHZ和 CS变化趋势显示为上升的变化趋势,其中 CS的上升幅度最大,达215%;而 GA1、GA4和SA则显示为下降的变化趋势.在花芽→ 小花苞分化阶段,除 CS上升29%外,其他激素均为下降的变化趋势.
高表达水平激素 GA7、cis-OPDA、ABA 和tzR 在三角梅侧端成花不同阶段差异大且显著(CV>0.3且p<0.01),可能主要参与成花调控;而 GA4、tZ、DHZ、CS和 ACC虽在 三 角 梅 早 期 花 芽 分 化(刺→花 刺)过程中水平明显 变 化(幅 度>50%)但 不 十 分 显 著(p>0.01),可能部分参与早期成花过程.其中,GA4、GA7、cis-OPDA、ABA、tZ、、DHZ、tzR、CS和 ACC 均 在 刺 → 花刺分化过程中水平上升,它们可能促进三角梅花芽 分化;而在花刺→小花苞分化过程中 GA4和 GA7则发生明显下降(幅度>50%),暗示其在三角梅花芽分化的中后期可能不参与调控或起抑制作用.
高表达水平激素 GA7和SA 在三角梅顶端成花不同阶段差异大且显著(CV>0.3且p<0.01),可能主要参与成花调控;而 GA4、tZ、DHZ、tzR 和 CS的水平在叶芽→ 花芽分化过程中均发生明显变化 (幅 度 >50%)但不十分显著(p>0.01);高表达水平激素cis-OPDA 变化幅度达30%且极显著(p=0.001),可能部分 参 与 早 期 成 花 过 程.其 中,GA7、cis-OPDA、tZ、DHZ、tzR和 CS在叶芽→花芽分化过程中水平上升,它们可能促进早期花芽分化;而 GA4和 SA 则明显下降(幅 度>50%),可 能 抑 制 早 期 花 芽 分 化.在 花 芽→ 小花 苞 分 化 过 程 中,仅 GA7 发 生 明 显 下 降 (幅 度 >50%),暗示 GA7可能不参与三角梅花芽中后期分化调控或起抑制作用.
2.3 三角梅成花过程中激素间的相互作用
对10种可能参与三角梅成花过程的内源激素水平变化进行相关性分析(图2),建 立 可 能 存 在 的 相 互作用网络(图3),并尝试确定其中的关键激素.在侧端成花过程中,9种激素根据相关程度聚成2个小群(图2(a)):GA4、DHZ、tZ、GA7和cis-OPDA 聚为一类,两两之间的相关系数均高于0.85,在花芽分化的过程中其水平均显示为先升高后下降的变化趋势;ABA、CS、tzR 和 ACC聚为一类,两两之间的相关系数均为1,水平在刺→花刺分化阶段明显升高,随后在花刺→小花苞分化阶段无明显变化.进一步相互作用网络分析揭示cis-OPDA、tZ和 GA7为节点激素,可能在成花的不同阶段扮演关键角色.所有在侧端成花组中发生显著变化的激素均为正相关,这些重要激素水平的升高可能促进三 角 梅 的 花 芽 分 化,随后水平下降或趋于稳定,花芽分化进入中后期.在顶端成花过程中水平显著变化的 7种 激 素 根据相关程度聚成3个小群(图2(b)):tZ和 CS聚为一类,两者的相关系 数 为0.85,在 叶 芽→花 芽 分 化 阶 段水平均为上升的变化趋势;GA4和SA 聚为一类,两者的相关系数为0.99,在花芽分化不同阶段水平都显示为下 降 的 变 化 趋 势,且 与 CS 的 水 平 呈 明 显 负 相 关;GA7、cis-OPDA 和 DHZ 聚 为 一 类,两两之间的相关系数均高于0.60,三者在叶芽→花芽分化阶段水平均明显升高,随后在花芽→小花苞分化阶段呈现下降的变化趋 势.进一步相互作用网络分析揭示 tZ、cis-OPDA 和 GA4为节点激素,其中tZ和 GA4呈 高 度 负相关,可能存在相互抑制的关系(图3(b)).在 叶 芽→ 花芽分 化 过 程 中,DHZ 水平的迅速升高以及 cis-OPDA 和 GA7的高水平可能促进三角梅的花芽分化,随后这些激素水平均下降,花芽分化进入中后期.
3 讨论与结论
通过对19种植物内源激素在三角梅成花不同阶段的水平检测和统 计学分析,发 现 GA4、GA7、cis-OPDA、ABA、SA、tZ、DHZ、tzR、CS和 ACC的激素水平在三角梅 花 芽 分 化 的 主 要 过 程 (刺 → 花 刺 → 小 花苞、叶芽→花芽→小花苞)中发生不同程度的变化,可能参 与 三 角 梅 成 花 早 期 调 控,其 中 GA7、cis-OPDA、GA4和tZ可能作为节点激素在发挥关键作用.
3.1 不同激素参与三角梅成花过程与其他植物的异同
不同的 植 物 激 素 在 植 物 成 花 过 程 中 扮 演 迥 异 的调控角 色.在 生 产 实 践 中,外 源 GA 可以调节百子莲(Agapanthusafricanus)花茎的伸长和提早成花[18],提高 蝴 蝶 兰(Phalaenopsisaphrodite)抽 薹 率 并 提 早花期[19],促进 羊 草 花(Leymuschinensis)芽 分 化 和 成花[20];然而在木 本 果 树 中,GA 则是成花的主要抑制激素,如 Zhang 等[21]研 究 表 明 GA3 对 苹 果 (Malusdomestica)花的诱 导 有 一 定 的 延 迟 作 用.本 研 究 发 现GA 家族的4个成员在三角梅成花早期分化阶段的水平表现 有 差 异:其 中,GA1和 GA3在三角梅整个成花早期水平变化 相 对 GA4 和 GA7 较 小 且 不 显 著,可 能不参与三角梅成花过程;而 GA4和 GA7的水平在刺→ 花刺分化过程中升高幅度分别达610%和1388%,尤其是 GA7在三 角 梅 花 芽 分 化 的 不 同 阶 段 都 保 持 较 高水平,说明高水平的 GA4和 GA7对三角梅成花可能具有促进作用.cis-OPDA 是 合 成JA 和JA-Ile的 前 体,JA 在拟南芥中被认为参与植物成花调控,并具有调控成花时间的 作 用[22].本 研 究 中,cis-OPDA 水 平 高,而JA 和 JA-Ile水 平 较 低,该 结 果 与 陈 康 等[23]在 人 参(Panaxginseng)花 中 的 研 究 结 果 相 似.由 于 激 素 本身具有级联 放 大 的 作 用 效 果,高 浓 度 的cis-OPDA 可为诱导大量JA 信号提供物质基础,而JA 和JA-Ile本身维持较低的浓度才是常态.tzR 可促进细胞分裂,调控花形态建成中的物质和能量代谢,并有助于花形态的分化.本研究中,tzR在侧端和顶端成花路径的未分化期→分化初期阶段分别升高350%和63%,对三角梅的花芽分化具有明显的促进作用,与孙红梅等[24]在金花茶(Camellianitidissima)花 及 姜 成 英 等[25]在 油橄榄(Oleaeuropaea)中的研究结果相符.IAA 是调控植物成花的常见激素之一,低浓度时可以促进花芽分化,而高浓度时则起抑制作用[26].本研究发现,在三角梅的成花过程中IAA 浓度一直维持在较低水平,而在未分化的小叶中IAA 浓度则维持在较高水平,与前人的研究结果相符.
相同激素在不同的植物中也可能发挥完全相反的作用.例如,高 水 平 ABA 能 促 进 侧 柏(Platycladusorientalis)成 花[27],而 对 枇 杷 (Eriobotryajaponica)植株喷洒 ABA 却可以有效地抑制其成花[28].在三角梅中,本研究发 现 ABA 在侧端成花的未分化期→分化初期(刺→花刺)阶段水平提升了230%,说明 ABA可能促进三角梅侧端成花,这与前期研究发现高水平ABA 能促进 苹 果 成 花[29]的 结 论 一 致;然 而,ABA 在顶端成花早期(叶 芽→花 芽)阶 段 保 持 较 低 水 平 且 变化较小(8%);暗示 ABA 在三角梅顶端成花中可能不起作用或有一定的抑制作用.
3.2 三角梅顶端和侧端成花的激素相互作用差异
植物成花是一个复杂的过程,在不同阶段受不同激素 的 调 控,植 物 内 源 激 素 之 间 也 存 在 着 相 互 作 用.例如,外源 GA3处理苹果会增加IAA 水平,降低tzR、ABA 水平,从而抑制花芽分化[21].在三角梅的成花过程中,本研究发现激素之间也存在相互作用,例 如 在成花早 期,GA7和 GA4水平变化保持着较好的相关性.虽然 GA4在未分化期→分化初期阶段的侧端和顶端成花路径呈现上升和下降的不一致,但是在高等植物的 GA 代谢通路中,GA4和 GA7均由 GA9形成[30],因此可推测 GA4在 顶 端 和 侧 端 水 平 的 变 化 差 异 或 许是由 GA4和 GA7合成速度差异及其他调控因素(如光照)差异 所 致,需要进一步的分子实验证明.有 趣 的是,除 DHZ外,所有水平变化较大的激素(GA4、GA7、cis-OPDA、ABA、tZ、tzR、CS 和 ACC)都 在 三 角 梅 成花早期有大幅度的水平提升且相互促进,这说明三角梅的侧端可能通过提高这些激素的水平来促进成花.在顶端成花过 程 中,CS与 GA4、SA 的 水 平 存 在 高 度负相关,GA4与SA 之间则存在高度正相关.跟踪激素水平变化发现,GA4和SA 在三角梅成花的未分化期→ 分化初期阶 段 均 有 明 显 下 降 趋 势,CS的 水 平 则 有 明显升高.因此,GA4和SA 可能对顶端成花过程中的花芽分化起抑制作用,并与 CS相互拮抗。——论文作者:罗 颀1,林 哲2,黄政档1,侯海涛1,陈自亮3* ,洪陈洁1,詹福麟3,郭杭琪3,许婷婷2,郭小玲4,陈 亮2,纪志梁2*
转载请注明来自:http://www.lunwencheng.com/lunwen/nye/21699.html