摘 要: 目的 分析不同巴氏杀菌处理下绵羊乳蛋白的结构变化, 并以牛乳为对照, 比较二者差异性。方法分别以低温长时巴氏杀菌(65 ℃ 30 min)、高温短时巴氏杀菌(85 ℃ 15 s)和超巴氏杀菌(121 ℃ 5 s)对绵羊乳、牛乳进行杀菌处理, 探究 3 种巴氏杀菌处理对绵羊乳和牛乳总蛋白及乳清蛋白二级结构的影响。结果 3 种巴氏杀菌处理均会影响绵羊乳总蛋白和乳清蛋白二级结构, 改变乳蛋白原空间结构; 相比总蛋白, 乳清蛋白二级结构稳定性受热处理影响更大(P<0.05), 超巴氏杀菌处理对绵羊乳总蛋白与乳清蛋白二级结构影响最大, 乳清蛋白变性程度最大。绵羊乳与牛乳在 3 种巴氏杀菌处理方式下蛋白二级结构的变化规律略有差异。结论 3 种巴氏杀菌处理下低温长时巴氏杀菌绵羊乳蛋白结构及组成变化最小, 且绵羊乳总蛋白与乳清蛋白二级结构的变化规律与牛乳略有不同, 在绵羊乳液态奶加工时应引起足够重视。
关键词: 绵羊乳; 巴氏杀菌; 乳蛋白; 二级结构
0 引 言
绵羊乳是一种渐受重视的特色优质小品种乳源, 干物质含量在各种乳源中含量最高, 平均高达 16%以上, 口感细腻, 营养丰富, 富含蛋白质、脂肪、乳糖、矿物质、维生素等多种营养素, 及多种功能营养因子如乳铁蛋白、免疫球蛋白等[1‒2]。我国绵羊乳产业正处于发展初期阶段, 是乳品市场的一颗新星, 其加工制品具有广阔市场前景, 可为羊乳产业增添新动能[3‒4]。目前国内外绵羊乳加工技术方面研究相关报道偏少, 缺乏重要文献支撑, 制约了绵羊乳高值化利用以及产业化加工的发展进程。巴氏杀菌处理是乳品加工的主要热加工方式, 是保证液态乳商品流通过程中质量稳定和符合卫生标准的必要条件[5‒6]。国内外常用的巴氏杀菌方法主要有 3 种: 低温长时巴氏杀菌 (65 ℃ 30 min)[7‒8]、高温短时巴氏杀菌(85 ℃ 15 s)[9‒10]和超巴氏杀菌(121 ℃ 5 s)[11]。不同乳源适合于不同的热加工工艺, 巴氏杀菌是较为温和的热处理方式, 对富含热敏性功能营养因子的乳源更为重要。巴氏杀菌处理可有效控制乳中的微生物指标, 延长货架期, 但这一热处理同样会引起乳理化性质、营养风味成分的改变[12‒15]。乳蛋白是乳的重要营养素, 其在巴氏杀菌处理过程中的结构变化与热稳定性息息相关, 且乳清蛋白对热处理更为敏感[16‒17], 同时不同乳种表现出较为不同的乳蛋白热稳定性[18]。但目前国内外巴氏杀菌处理过程中乳蛋白稳定性的相关研究以牛乳、山羊乳为主[19‒23], 如 ZHAO 等[19]发现低温长时巴氏杀菌处理对山羊乳乳清蛋白二级结构的影响小于超巴氏杀菌处理, 孙佳悦等[22]发现热处理会导致牛乳蛋白间发生相互作用, 形成热变性乳蛋白聚合物, 且热处理程度增强会显著影响乳蛋白二级结构。绵羊乳巴氏杀菌处理的相关研究较少, 吴仪凡等[24]发现绵羊乳热加工特性较牛乳脆弱, 低温长时杀菌方式对绵羊乳的理化特性(离心沉淀量、蛋白粒径、zeta 电位等)影响最小, 但未见关于巴氏杀菌处理过程中绵羊乳乳蛋白稳定性的报道。
本研究探讨低温长时巴氏杀菌(65 ℃ 30 min)、高温短时巴氏杀菌(85 ℃ 15 s)和超巴氏杀菌(121 ℃ 5 s)对绵羊乳总蛋白及乳清蛋白二级结构的影响, 并以牛乳为对照, 分析绵羊乳与牛乳在不同巴氏杀菌处理下乳蛋白结构变化的差异性, 以期为科学选择绵羊乳工业化加工热处理方式提供理论依据。
1 材料与方法
1.1 材 料
新鲜绵羊乳采自甘肃省金昌市, 新鲜牛乳采自陕西杨凌良种肉牛繁育中心, 采集乳样后, 密封并在 4 ℃冰盒内冷藏运至实验室。
1.2 仪器与试剂
Vertex 70 傅立叶变换红外光谱仪(德国布鲁克公司); LGJ-25C 真空冷冻干燥机(北京四环仪器厂); HC-3618R 高速冷冻离心机 ( 安徽中科中佳科学仪器有限公司 ); ME303E/02精密天平[梅特勒-托利多仪器(上海)有限公司]; PT-20C 管板组合式杀菌机(上海沃迪科技有限公司) 盐酸(分析纯, 国药集团化学试剂有限公司); 双金鸡纳酸(bicinchoninic acid, BCA)试剂盒(北京索莱宝科技有限公司)。
1.3 实验方法
1.3.1 样品热处理
选用低温长时巴氏杀菌(65 ℃ 30 min)、高温短时巴氏杀菌(85 ℃ 15 s)、超巴氏杀菌(121 ℃ 5 s) 3 种乳品加工常用的杀菌方法对原料乳进行处理, 热处理后的乳样于 4 ℃ 冷藏以测定相关指标。
1.3.2 乳蛋白及乳清蛋白制备
乳蛋白制备: 取不同热处理后的乳样于 4 ℃、 8000 r/min 离心 20 min, 弃上层脂肪, 收集下层蛋白溶液, 冷冻干燥后成粉末状备用。
相关知识推荐:投杀菌论文有什么北大核心期刊
乳清蛋白制备: 用 1 mol/L 的盐酸将牛乳 pH 调至 4.6, 绵羊乳 pH 调至 4.2, 在 4 ℃、8000 r/min 下离心 20 min, 去掉上层脂肪和下层酪蛋白, 得到乳清蛋白。
1.3.3 全蛋白与乳清蛋白二级结构的测定
选用中红外衰减全反射光谱模式 , 所选条件为4000~400 cm‒1 波段, 扫描 32 次, 分辨率为 4 cm‒1。利用 PeakFit v4.12 软件对谱带范围内(酰胺 I 带 1700~1600 cm‒1) 处理分析, 确定各子峰与各个二级结构单元的对应关系后, 根据峰面积计算各二级结构组分的相对百分含量[22]。 1.3.4 乳清蛋白含量的测定准确称取 10 g 绵羊乳和牛乳试样, 用 1 mol/L 的盐酸将牛乳 pH 调至 4.6 左右, 将绵羊乳 pH 调至 4.2 左右, 在 8000 r/min 条件下离心 10 min, 去掉上层脂肪和下层沉淀[25], 用凯氏定氮法测定试样中氮含量, 换算为乳清蛋白含量, 以此来计算试样中乳清蛋白含量。计算公式如公式 (1)所示。
乳清蛋白含量/%=(乳清蛋白/试样质量)×100% (1)
1.3.5 非变性凝胶电泳
样品制备[25‒26]: (1)制备乳清蛋白: 用 1 mol/L 的盐酸将牛乳 pH 调至 4.6 左右, 将绵羊乳 pH 调至 4.2 左右, 在 8000 r/min 条件下离心 10 min, 去掉上层脂肪和下层酪蛋白。(2)样品稀释: 采用 BCA 试剂盒测定蛋白浓度, 用超纯水将样品蛋白浓度稀释至 4.0 μg/μL。(3)制备上样溶液: 将稀释后的试样与等体积的 2×非变性样品缓冲液充分混合, 4 ℃、5000 r/min 离心 10 min。
电泳条件: 分离胶浓度选用 12.5% (V:V), 浓缩胶浓度选用 4% (V:V), 电流选用 15 mA, 30 mA, 上样浓度为 4.0 μg/μL, 上样量为 10 μL, 电泳在 0~4 ℃下进行。
1.4 数据统计分析
以上所有实验均至少重复 3 次, 结果以平均值±标准差表示, 利用 SPSS 18.0 软件对数据进行单因素方差分析 (analysis of variance, ANOVA)、最小显著性差异法(least significant difference, LSD) 多重比较 , 显著水平设为 P<0.05。
2 结果与分析
2.1 巴氏杀菌处理对绵羊乳总蛋白二级结构的影响
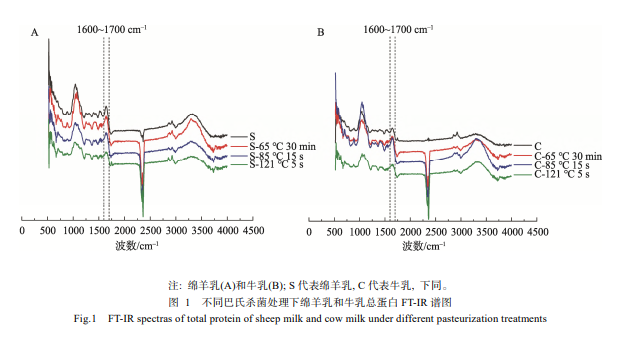
通过傅里叶红外光谱仪(Fourier transformation infrared spectroscopy, FT-IR)对不同巴氏杀菌处理下的绵羊乳及牛乳总蛋白进行全波段扫描, 结果如图 1 所示。从整体看, 绵羊乳和牛乳不同巴氏杀菌处理与未处理乳总蛋白的 FT-IR 谱图的整体变化规律无较大差异。羟基(O-H)的伸缩振动在 3670~3230 cm‒1, 游离的 O-H 峰尖, 且大于 3600 cm‒1, 缔合的 O-H 移向低波数, 峰加宽, 在小于 3600 cm‒1 处, 缔合程度越大, 峰越宽, 越移向低波数处[27]。绵羊乳、牛乳总蛋白 FT-IR 谱图中 3400 cm‒1 左右呈现宽吸收峰, 说明总蛋白中存在大量 O-H, 与孙佳悦等[22]研究结果一致。
图 1 中酰胺Ⅰ带(1600~1700 cm‒1)由羰基(C=O)键伸缩振动产生[22], 其峰型受蛋白质特定二级结构影响。不同二级结构信息均叠加酰胺Ⅰ带, 根据谱图确定各子峰与各二级结构对应关系, 酰胺Ⅰ带各谱峰归属为: β 折叠特征峰为 1640~1610 cm‒1, 无规则卷曲特征峰为 1650~1640 cm‒1, α 螺旋特征峰为 1658~1650 cm‒1, β 转角特征峰为 1695~ 1660 cm‒1, 根据峰面积计算 β 折叠、无规则卷曲、α 螺旋及 β 转角的相对含量。
巴氏杀菌破坏了维持 α 螺旋的氢键[28], 由表 1 可知, 牛乳总蛋白二级结构中 α 螺旋相对含量均显著降低, 其中绵羊乳 α 螺旋相对含量在超巴氏杀菌处理下显著降低 (P<0.05)。巴氏杀菌使得绵羊乳和牛乳蛋白中无规则卷曲增加, 但牛乳增加显著(P<0.05), 说明乳蛋白部分结构由有序转向无序, 这与孙佳悦等[22]所探究的结果类似。巴氏杀菌处理对牛乳总蛋白结构中 β 折叠和 β 转角的相对含量影响不显著(P>0.05), 但巴氏杀菌处理显著降低了绵羊乳总蛋白中 β 折叠的相对含量(P<0.05), 这是因为 β 折叠结构对于蛋白空间网状结构的形成具有独特的作用, 常见于折叠区域, 但其结构不稳定, 热处理易于对其造成破坏, 随着处理温度的升高, 蛋白变性, 形成聚集体, 在聚集体状态下, β 折叠易于转向 β 转角及无规则卷曲[29]。而绵羊乳相对于牛乳对热更敏感[24], 因此巴氏杀菌处理降低了牛乳和绵羊乳总蛋白中 β 折叠的相对含量, 在绵羊乳中变化显著而牛乳中不显著(P>0.05)。绵羊乳总蛋白二级结构的稳定性随温度升高而降低, 且不同巴氏杀菌处理下绵羊乳总蛋白二级结构变化与牛乳不同, 这可能与这 2 种乳蛋白组成的差异有关, 而乳蛋白组成与巴氏杀菌处理下二级结构变化规律的相关性仍有待进一步研究。
2.2 巴氏杀菌处理对绵羊乳乳清蛋白二级结构的影响
不同巴氏杀菌处理下绵羊乳及牛乳乳清蛋白红外谱图如图 2 所示, 从整体看, 绵羊乳和牛乳不同巴氏杀菌处理与未处理乳乳清蛋白的 FT-IR 谱图的整体变化规律同样无较大差异, 但绵羊乳与牛乳之间的 FT-IR 谱图不尽相同。
对酰胺Ⅰ带波段谱图进行相同处理, 结果如表 2 所示。巴氏杀菌可显著增加牛乳乳清蛋白二级结构中无规则卷曲的相对含量、显著降低 α 螺旋的相对含量(P<0.05), 而对牛乳乳清蛋白结构中 β 转角的相对含量影响并不显著 (P>0.05); 巴氏杀菌处理显著降低了绵羊乳乳清蛋白 β 折叠相对含量, 无规则卷曲相对含量升高不显著(P>0.05)。这可能是由于 β 折叠结构位于蛋白质凝聚体内部, 较长时间的热处理使乳清蛋白中部分蛋白发生凝聚, 在经过离心后 β 折叠结构随着凝聚体过滤出去而含量降低; α 螺旋相对含量减少可能是由于高温导致蛋白质分子间或分子内氢键的断裂, 蛋白质发生了去折叠; 高温处理时, 会发生 β 转角向无规则卷曲转变, 结构变得更为无序, 使 β 转角含量降低、无规则卷曲含量增加[17]。而巴氏杀菌对绵羊乳乳清蛋白二级结构的影响不同于牛乳, 这可能与这 2 种乳中乳清蛋白的组成差异有关。
通过比较不同巴氏杀菌处理对绵羊乳及牛乳总蛋白和乳清蛋白二级结构的影响发现, 在相同处理下, 总蛋白二级结构的变化程度小于乳清蛋白二级结构的变化程度, 说明乳清蛋白热稳定性低于总蛋白热稳定性, 与 YE 等[30] 和 GENENE 等[31]得到的结论类似。
2.3 巴氏杀菌处理对绵羊乳乳清蛋白变性程度的影响
相比酪蛋白, 乳清蛋白具有更高热敏感性, 利用等电点沉淀酪蛋白、离心后测定不同巴氏杀菌处理对绵羊乳及牛乳乳清蛋白含量的影响, 结果如图 3 所示。由测定结果发现, 牛乳乳清蛋白含量随巴氏杀菌温度升高而显著下降 (P<0.05), 高温短时巴氏杀菌、超巴氏杀菌处理显著减少了绵羊乳乳清蛋白含量(P<0.05), 而低温长时巴氏杀菌处理对绵羊乳乳清蛋白无显著影响; 3 种巴氏杀菌处理均改变了绵羊乳和牛乳乳清蛋白含量。这是由于经过热处理的乳清蛋白发生变性, 乳清蛋白中 β-乳球蛋白的分子间聚合、 β-乳球蛋白和 α-乳白蛋白聚合、α-乳白蛋白的分子间聚合或者乳清蛋白与酪蛋白、乳糖之间发生相互作用而形成凝聚物, 导致乳清蛋白溶解性减小[17,19], 测得的乳清蛋白含量变低, 这与其二级结构的变化规律一致。因此, 这说明低温长时巴氏杀菌引起的绵羊乳乳清蛋白变性程度远小于高温短时巴氏杀菌、超巴氏杀菌。
进一步通过非变性凝胶电泳比较不同巴氏杀菌对绵羊乳及牛乳乳清蛋白组成的影响。由图 4 可知, 在绵羊乳和牛乳中, 随巴氏杀菌温度升高, 85 ℃下乳清蛋白中血清白蛋白先发生变性, 在超巴氏杀菌处理后, 绵羊乳、牛乳中乳铁蛋白条带消失, 同样, 绵羊乳中 α-乳白蛋白和 β-乳球蛋白条带明显变暗, 而牛乳中 α-乳白蛋白和 β-乳球蛋白的变化小于绵羊乳, 电泳结果可证明乳清蛋白含量测定结果。李荣蓉等[32]在骆驼乳蛋白稳定性实验中发现, 骆驼乳中血清白蛋白在 65 ℃处理下下变化不显著, 85 ℃处理后稍有降低, 当温度高于 90 ℃时, α-乳白蛋白含量显著降低, 这结果与本研究结果相一致。刘海燕等[33]在乳铁蛋白热稳定动力模型中发现, 乳铁蛋白蛋白含量在温度超过 72 ℃ 时开始降低, 超高温瞬时灭菌乳中已不存在天然乳铁蛋白,与本研究发现低温长时和高温短时巴氏杀菌处理对绵羊乳和牛乳中乳铁蛋白含量影响较小, 超巴氏杀菌处理后绵羊乳和牛乳中乳铁蛋白条带消失的结果相吻合。
3 结论与讨论
本研究通过傅里叶红外光谱仪测定不同巴氏杀菌处理对绵羊乳总蛋白、乳清蛋白二级结构的影响, 发现 3 种巴氏杀菌处理使绵羊乳总蛋白、乳清蛋白二级结构被破坏, 其中超巴氏杀菌处理最为严重, 使得乳蛋白二级结构由有序转向无序, 且绵羊乳乳清蛋白二级结构受巴氏杀菌处理的影响大于总蛋白。巴氏杀菌处理下牛乳蛋白二级结构变化规律与绵羊乳略有不同, 这可能与绵羊乳更为复杂的蛋白组成相关。未变性的绵羊乳和牛乳乳清蛋白含量随巴氏杀菌处理温度升高而显著降低(P<0.05), 超巴氏杀菌处理下绵羊乳、牛乳乳清蛋白变性程度最为严重。因此, 从绵羊乳的热稳定性考虑, 3 种巴氏杀菌处理中最适用于绵羊乳的是低温长时巴氏杀菌, 本研究可为绵羊乳制品热加工处理方式的科学选择提供一定理论依据。——论文作者:康 鹏 1 , 雷晓民 2 , 葛武鹏 1*, 吴仪凡 1 , 王海燕 1 , 李博为 1 , 吕 欣 1
参考文献
[1] MOATSOU G, SAKKAS L. Sheep milk components: Focus on nutritional advantages and biofunctional potential [J]. Small Rumin Res, 2019, 180: 86‒99.
[2] BALTHAZAR CF, PIMENTEL TC, FERR OLL, et al. Sheep milk: Physicochemical characteristics and relevance for functional food development [J]. Comprehens Rev Food Sci Food Saf, 2017, 16(2): 247‒262.
[3] ANNA N, ALBERTO SA, FABIO C, et al. Effects of nutrition on main components of sheep milk [J]. Small Rumin Res, 2020, 184: 106015.
[4] 宋宇轩, 安小鹏, 张磊, 等. 奶绵羊产业概况及中国奶绵羊产业的前景分析[J]. 中国乳业, 2019, (8): 16‒21. SONG YX, AN XP, ZHANG L, et al. Overview of dairy sheep industry and prospect analysis of China’s dairy sheep industry [J]. China Dairy, 2019, (8): 16‒21.
[5] 孙琦. 牛乳热加工特性及其盐类平衡的研究[D]. 北京: 中国农业科学院, 2012. SUN Q. Study on the thermal processing characteristics of milk and its salt balance [D]. Beijing: Chinese Academy of Agricultural Sciences, 2012.
[6] 韩荣伟, 王加启, 郑楠. 热处理对牛乳成分的变化影响及热损标识物的选择[J]. 中国食物与营养, 2011, 17(7): 22‒29. HAN RW, WANG JQ, ZHENG N. The influence of heat treatment on the changes of milk components and the selection of heat damage markers [J]. China Food Nutr, 2011, 17(7): 22‒29.
[7] 吕加平, 张书文, 刘鹭, 等. 巴氏杀菌奶加工技术及质量控制现状[J]. 食品科学技术学报, 2016, 34(1): 9‒15. LV JP, ZHANG SW, LIU L, et al. Current status of pasteurized milk processing technology and quality control [J]. J Food Sci Technol, 2016, 34(1): 9‒15.
[8] 顾佳升. 关于巴氏杀菌奶[J]. 乳业科学与技术, 2005, 3(3): 97‒99. GU JS. About pasteurized milk [J]. J Dairy Sci Technol, 2005, 3(3): 97‒99.
[9] SMIT G. 现代乳品加工与质量控制[M]. 任发政, 韩北忠, 罗永, 等主译. 北京: 中国农业大学出版社, 2006. SMIT G. Modern dairy product processing and quality control [M]. REN FZ, HAN BZ, LUO Y, et al. Translators. Beijing: China Agricultural University Press, 2006.
[10] 顾佳升, 龚林妹, 夏静. 我国液态奶产品的系统分类和命名[J]. 食品工业, 2004, (1): 23‒24. GU JS, GONG LM, XIA J. System classification and naming of liquid milk products in my country [J]. Food Ind, 2004, (1): 23‒24.
[11] JUNG JW, JUN J, MIM TS, et al. Effects of heat treatment on the nutritional quality of milk. IV [J]. J Dairy Sci Biotechnol, 2017, 35(4): 270‒285.
[12] 黄庆飞, 戴永恒, 徐雪华. 玻璃瓶装巴氏杀菌奶微生物指标的控制[J]. 广西畜牧兽医, 2004, (5): 207‒209. HUANG QF, DAI YH, XU XH. Control of microbial indicators of pasteurized milk in glass bottles [J]. Guangxi Anim Husband Veter Med, 2004, (5): 207‒209.
[13] LIU HY, IRINA B, MIKE W, et al. Kinetic modelling of the heat stability of bovine lactoferrin in raw whole milk [J]. J Food Eng, 2020, 280: 109977.
[14] DEETH HC, LEWIS MJ. High temperature processing of milk and milk products [M]. New Jersey: Wiley Balckwell, 2017.
[15] 赵春卉, 项爱丽, 张立田, 等. 乳制品热处理强度评价方法研究进展 [J]. 中国奶牛, 2018, (7): 63‒65. ZHAO CH, XIANG AIL, ZHANG LT, et al. Research progress on heat treatment strength evaluation methods of dairy products [J]. China Dairy Cattle, 2018, (7): 63‒65.
[16] 张雪喜. 羊乳乳清蛋白的热变性作用及其微观特性和功能性质研究 [D]. 济南: 齐鲁工业大学, 2018. ZHANG XX. Study on the thermal denaturation, microscopic and functional properties of goat milk whey protein [D]. Jinan: Qilu University of Technology, 2018.
转载请注明来自:http://www.lunwencheng.com/lunwen/nye/22237.html