摘 要:为研究高强度ps脉冲电场(psPEF)诱导 HeLa细胞的生物电效应,将脉冲电场参数组合(电场强度为250kV/cm,脉宽为800ps,脉冲个数 为1000、3000、5000,频 率 为3 Hz)作 用 于 人 宫 颈 癌 HeLa细 胞。利 用 噻 唑 蓝(methylthiazolyltetrazolium,MTT)比色法检测ps脉冲对细胞的生长抑制情况;钙离子指示剂(Fluo-3/AM)探针标记细胞,激光共聚焦显微镜检测细胞内钙离子体积分数的改变;蛋白质印迹法检测促凋亡蛋白 Bax与 凋 亡 抑 制蛋白 Bcl-2释放水平的改变。实验发现:细胞死亡率与施加脉冲个数正相关,且处理后12h抑制率最高;激光扫描共聚焦半定量分析显示,处理组细胞荧光强度明显高于对照组(检验水准 P<0.05);蛋白质印迹法检测结果表明,处理组细胞内 Bax表达量增加(P<0.05),Bcl-2释放量略有降低。上述结果表明:高强度ps脉冲通过诱导细胞凋亡进而抑制了 HeLa细胞的增殖。
关键词:ps脉冲电场 (psPEF);HeLa细胞;生物电效应;噻唑蓝 (MTT);激光共聚焦显微镜;细胞凋亡
0 引言
脉冲电场以其独特的生物电效应成为近年来研究的热点,并广泛应用于基因转染、药物导入、肿瘤治疗、创伤修复等领域[1]。
以往研究表明,在 ms与μs级脉冲电场作用下,细胞膜通透性暂时增加使得生物大分子自由通过;脉冲电场取消后,细胞膜通透性自行恢复而未出现任何损伤,即电穿孔[2-4]。利用电穿孔可以实现基因转染,第1篇研究电穿孔用于鼠科动物细胞基因转染(电基 因 转 染)的 文 章 发 表 于1982年[5],并 且 从1996年 起,脱 氧 核 糖 核 酸 (deoxyribonucleicacid,DNA)分子电基因转染取得了极大的成功,正在取代传统的基因转染方法[6-11]。电穿孔的另一个重要用途是临床肿瘤治疗,即 电 化 学 疗 法(electrochemo-therapy,ECT)。ECT将化学疗法与电场脉冲相结合,提高化疗药物的转染率,降低化疗药物的注射剂量,极大程度上减小机体炎症等不良反应。日本学者率先将ECT应用于临床[12],此后人们相继将其用于皮肤癌、肝癌等疾病的临床治疗[13-15]。
近年来研究发现,场强>10kV/cm 的ns脉冲可以诱发肿瘤细胞内部(细胞核、线粒体、内质网等)结构和功能的改变,进而诱导其凋亡[16-20]。Nuccitelli等揭示ns脉冲通过诱导肿瘤细胞凋亡达到抑制荷瘤鼠肿瘤组织生长的效果,并进行了相应的脉冲电场参数优化,利用特殊设计的吸附电极,场强为30kV/cm、脉宽为100ns,重复频率为5~7Hz的2000个ns脉冲可以一次性消融裸鼠的黑色素瘤[21-23]。
然而,上述 ms、μs及ns脉冲电场在用于临床肿瘤治疗时,需借助电极将电脉冲引入人体,在一定程度上会对人体组织、器官等造成损伤,使其应用范围大大受限,因此寻求一种无创手段将脉冲电场引入人体,成为解决上述问题的关键所在。
ps脉冲作为一种超宽带脉冲,可以通过超宽带冲激脉冲辐射天线进行发射[24-25],将其脉冲电场聚焦于肿瘤组织,进而实现基于靶向凋亡诱导的肿瘤无创治疗。
同时全时段与频段电场脉冲的窗口效应理论揭示,随着脉冲电场脉宽的降低,其作用的细胞结构亦发生转移[26-28]。因此,高强度ps脉冲很可能直接作用于膜蛋白,使其构象发生改变,从而实现细胞功能的更精细调控。目前,ps脉冲的生物电效应研究在国内外鲜有报道。
本文首次将ps脉冲参数组合(电场强度为250kV/cm,脉 宽 为 800ps,脉 冲 个 数 为 1000、3000、5000,频率为3Hz)作用于人宫颈癌 HeLa细胞,以探索高强度ps脉冲电场的生物电效应。
1 材料与方法
1.1 实验材料
人宫颈癌 HeLa细胞株来自重庆医科大学超声工程研究所;新生胎牛血清、RoswellPark MemoriaInstitute-1640(RPMI-1640)培 养 基、磷 酸 缓 冲 液(phosphatebuffersolution,PBS)、胰 蛋 白 酶 均 购 自Hyclone公 司;MTT、二 甲 亚 砜(dimethylsulfoxide,DMSO)、Fluo-3/AM、Bradford蛋白浓度测定试剂盒、细胞裂解液均购自碧云天公司;促凋亡基因(Bax)兔抗人多克隆抗体、抑制凋亡基因(Bcl-2)兔抗人多克隆抗体、羊抗兔免疫球蛋白 G (immunoglobulinG,IgG)抗血清均购自北京博奥森生物技术有限公司。
1.2 ps脉冲源及电极腔室
高强度ps脉冲源为本课题组自行研制。输出脉冲参数为电压幅值50kV,脉宽800ps,重复频率3Hz。输出脉冲波形如图1所示。
电极腔室为实验室自行加工设计(见图2),绝缘部分由有机玻璃构成,导电部分由不锈钢构成,2个圆形电极的间距为2mm。将细胞悬液置于电极小室,施加脉冲进行处理。
1.3 实验方法
1.3.1 细胞培养
复苏人宫颈癌 HeLa细胞,将细胞置于含体积分数为10%的新生胎牛血清的 RPMI-1640培养基,于37°C、体积分数为5%的CO2 培养箱内培养,2~3d传代一次。
1.3.2 高强度ps脉冲处理
取对数期细胞,用体积分数为0.25%的胰蛋白酶消化后离心,PBS缓冲液洗涤2~3次后重悬,使细胞粒子数密度为2×106 mL-1。固定场强为250kV/cm、重复频率为3Hz、脉宽为800ps。按照脉冲个数的不同,将细胞分为对照组及低、中、高剂量处理组,各组对应的脉冲个数分别为:0、1000、3000、5000。每组取500μL细胞悬液置于电极小室,给予相应剂量的电脉冲,对照组不予电处理。
1.3.3 MTT检测死亡率
收集各组细胞,每组每孔吸取20μL细胞悬液接种于96孔板,调零组(只加培养液的空白组)仅加入培养液而不加细胞悬液,每组设5个复孔,共接种5块培养板,每组都于37°C、体积分数为5%的 CO2培养箱内培养2、12、48h后,每孔加入 MTT溶液20 μL,CO2 培养箱内培养4h,快速翻转培养板,弃去上清液,每孔加入二甲基亚砜(DMSO)150μL,于摇床上振荡15min,使 MTT蓝紫色结晶物充分溶解,选择570nm波长,在酶标仪上测定吸光值 A570。根据公式计算细胞死亡率:细胞死亡率(%)= (对照组A570-实验组 A570)/(对照组 A570-调零组 A570)× 100%,每组都单独重复实验3次,计算出每组细胞死亡率的平均值。以细胞死亡率为纵坐标、不同时间点为横坐标绘制剂量-效应曲线。
1.3.4 激光扫描共聚焦检测细胞内钙离子体积分数变化情况
细胞处理 及 分 组 同 前。取24孔 板,将 盖玻片(尺寸为8mm×8mm)置于孔中,加入 RPMI-1640(500μL)培养液于每孔,取处理组、对照组细胞各106 个种植于盖玻片上。由 MTT结果可知细胞在12h时死亡率达高峰,因此将24孔板置于37°C、体积分数为5%的CO2 培养箱培养12h。去除培养液后采用无血清培养液洗涤2次。加 入 量 浓 度为5 μmol/L的Fluo-3/AM 荧光探针,在37°C条件下避光孵育1h。采用PBS缓冲液洗涤3次。滴加10μL体积分数为5%的甘油于载玻片上,将盖玻片覆盖于甘油上,含细胞面接触甘油后封片。标本置于激光扫描聚焦显微镜(laserscanningconfocalmicroscope,LSCM)载物台上,倒置 荧 光 显 微 镜 (40倍 放大物镜)观察。
1.3.5 Westernblot法检测Bax、Bcl-2的表达
细胞处理及分组同前。收集脉冲处理后12h的各组细胞,采用PBS缓冲液重悬并计数,离心沉淀106 个细胞,用200μL细胞裂解液含苯甲基磺酰氟(phenylmethanesulfonylfluoride,PMSF)细胞裂解液冰浴裂解细胞60min后离心,最后收集上清液。以40μg蛋白质标本上样,经体积分数为12%的十二烷基磺酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳后分离蛋白质;电转至聚偏氟乙烯(PVDF)膜,于37°C条件下采用体积分数为5%的脱脂奶粉封闭60min;加入Bcl-2、Bax一抗,然后于4°C条件下夜间培养12h;TBST室温洗10min,重复3次;再加入二抗常温孵育60min,采用细胞缓冲液 (Tris-BufferedSalineandTween20,TBST)室温洗10min,重复3次;以细胞肌动蛋白(β-actin)水平作为等量蛋白上样对照检测激活型Bcl-2、Bax蛋白释放水平。
1.4 统计学方法
使用统计产品与服务解决方案 (statisticalprod-uctandservicesolutions,SPSS)17.0统计分析软件进行统计学处理,数据均用(均值)±s(标准差)表示,组间均数比较采用组间比较 (analysisofvariancebe-tweengroups,ANOVA)检验。检验水准P=0.05。
2 实验结果
2.1 MTT检测ps脉冲电场对 HeLa细胞的生长抑制作用
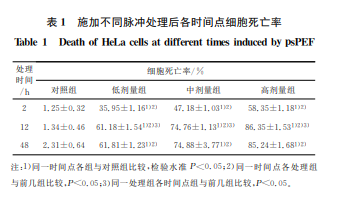
脉冲处理后2、12、48h各组细胞的生长抑制结果(见表1)。结果表明,HeLa细胞经脉冲电场处理后,生长均受到不同程度抑制。在同一时间点,细胞的抑制效应与施加脉冲个数正相关,且处理组细胞受到明显抑制(P<0.05);同一处理组细胞在12h时死亡率达到高峰,明显高于对照组的(P<0.05);12h及随后时间内细胞死亡率无明显变化(P>0.05)。
2.2 激光共聚焦检测细胞内钙离子体积分数的变化情况
Fluo-3/AM 易于进入细胞,被胞内的酯酶剪切形成Fluo-3,与细胞内游离 Ca2+ 结合产生较强的荧光,且荧光强度与钙离子体积分数成正比。因此可借助Fluo-3/AM 间接反映细胞内游离钙离子体积分数的变化,而 HeLa细胞经 Fluo-3/AM 装载后胞浆呈绿色荧光。图3为放大200倍的显微镜图,与对照组普遍低荧光相比(见图3(a)),处理组扫描视野内可见胞浆内荧光普遍增强(见图3(b)~(d))。处理 组(见 图 3(b)~(d))细胞荧光强度分 别 为58.40±4.80、75.89±8.93、101.72±9.62,均显著高于对照组的39.14±5.97。
2.3 Westernblot法检测Bax、Bcl-2的释放水平
对照组Bax释放水平较低,经ps脉冲处理后,其释放水平与施加脉冲剂量正相关;抗 凋 亡 蛋 白Bcl-2在各处理组释放水平较对照组有所减小,Bax与Bcl-2光密度比值上调,促凋亡作用明显,且高剂量组Bax与Bcl-2光密度比值上调现象最为明显,即其诱导凋亡的作用最强(见图4、5)。
3 讨论
如表1所示,ps脉冲处理 HeLa细胞后,细胞死亡率与对照组相比呈显著增加,说明ps脉冲可以有效抑制肿瘤细胞的增殖,从而为ps脉冲生物医学应用提供了实验支撑。
众所周知,Bax基因家族及其相关蛋白Bcl-2的表达情况是细胞凋亡的重要标志。为了进一步揭示ps脉冲生物电效应的机制,对ps脉冲处理后凋亡相关蛋白 Bax和 Bcl-2的释放水平情况进行了测定。结果显示处理组细胞Bax与Bcl-2光密度比值上调,且高剂量组最为明显,说明高强度ps脉冲电场能影响细胞的生存状态,使细胞内 Bax具有较高的释放水平,从而诱导细胞凋亡的发生。本文探明了高强度ps脉冲电场诱导肿瘤细胞凋亡的生物电效应,从而为基于靶向凋亡诱导的高强度ps脉冲无创治疗技术奠定了实验基础。然而,欲实现上述无创治疗技术的临床化,仍需进一步揭示ps脉冲诱导凋亡的分子机制,这将是后续研究工作的重点之一。
本文来源于:《高电压技术》为国内外唯一集中、全面地反映当前高电压技术领域科技信息的专业技术刊物,本刊报道内容包括高压设备、输电线路、系统暂态、测试工程、电磁、城网供电、电力电子等及生态环保生物医疗等边缘、交叉学科。既有基础理论研究也有工程实践应用。
4 结论
本文将脉冲电场参数组合(电 场 强 度 为250 kV/cm,脉 宽 为 800ps,脉 冲 个 数 为 1000、3000、5000,频率为3Hz)作用于人宫颈癌 HeLa细胞。利用 MTT比色法检测ps脉冲对细胞的生长抑制情况;用Fluo-3/AM 探针标记细胞,激光共聚焦显微镜检测细胞内钙离子体积分数的改变;Westernblot检测Bax与Bcl-2光密度比值的改变,得出以下结论:
1)高强度ps脉冲可以有效抑制肿瘤细胞增殖。
2)高强度ps脉冲诱导胞内Ca2+体积分数升高,从而触发相应的凋亡通路。
3)高强度ps脉冲诱导肿瘤细胞凋亡,为基于凋亡靶向诱导的肿瘤无创治疗技术提供了理论依据。——论文作者:郭 飞1,姚陈果1,章锡明1,孙才新1,张 玉2,熊正爱2
参考文献 References
[1]DevSB,RabussayDP,WideraG,etal.Medicalapplicationsofelectroporation[J].IEEE TransactionsonPlasmaScience,2000,28(1):206-223.
[2]NeumannE,RosenheckK.Permeabilitychangesinducedbye-lectricimpulsesinvesicularmembranes[J].Journalof Mem-braneBiology,1972,10(3):279-290.
[3]ZimmermannU,VienkenJ,PilwatG.Dielectricbreakdownofcellmembrane[J].BiophysicalJournal,1974,14(11):881-899.
[4]WeaverJC.Electroporationofcellsandtissue[J].IEEETrans-actionsonPlasmaScience,2000,28(1):24-33.
[5]NeumannE,SchaefreR M,WangY,etal.Genetransferintomouselyomacellsbyelectroporationinhighelectricfields[J].TheEMBOJournal,1982,1(7):841-845.
[6]RolsMP,DelteilC,GolzioM,etal.Invivoelectricallymedia-tedproteinandgenetransferin murinemelanoma[J].NatureBiotechnology,1998,16(2):168-171.
[7]SuzukiT,ShinBC,FujikuraK,etal.Directgenetransferintoratlivercellsbyinvivoelectroporation[J].FEBS Letters,1998,425(3):436-440.
[8]AiharaH,MiyazakiJ.Genetransferintomusclebyelectropo-rationinvivo[J].NatureBiotechnology,1998,16(9):867-870.
[9]MirLM,BureauMF,RangaraR,etal.Long-term,highlevelinvivogeneexpressionafterelectricpulse-mediatedgenetrans-ferintoskeletalmuscle[J].ComptesRendusdeIcadémiedessciencesⅢ,1998,321(11):893-899.
[10]NishiT,YoshizatoK,YamashiroS,etal.High-efficiencyinvivogenetransferusingintraarterialplasmid DNAinjectionfollowinginvivoelectroporation[J].CancerResearch,1996,56(5):1050-1055.
[11]HellerR,JaroszeskiM,AtkinA,etal.Invivogeneelectroin-jectionandexpressioninratliver[J].FEBSLetters,1996,389(3):225-228.
[12]OkinoM,MohriH.Effectsofahigh-voltageelectricalimpulseandananticancerdrugoninvivogrowingtumors[J].JapaneseJournalofCancerResearch,1987,78(12):1319-1321.
[13]MirL M,GlassLF,SeraG,etal.Effectivetreatmentofcu-taneousandsubcutaneousmalignanttumorsbyelectrochemo-therapy[J].BritishJournalofCancer,1998,77(12):2336-2342.
[14]HofmannG A,DevSB,DimmerS,etal.Electroporationtherapy:anewapproachforthetreatmentofheadandneckcancer[J].IEEE Transactionson BiomedicalEngineering,1999,46(6):752-759.
[15]HellerR,GilbertR,JaroszeskiM J.Clinicalapplicationsofelectrochemotherapy[J].Advanced Drug Delivery Reviews,1999,35(1):119-129.
转载请注明来自:http://www.lunwencheng.com/lunwen/dzi/21938.html