摘要:以掺杂Cu的类水滑石(Cu-HTs)作为载体,Cu-HTs中高分散的构晶离子Cu2+作为定位剂,利用Cu和Pd间的强相互作用,诱导Pd原子定位分散在载体表面,得到小尺寸和高分散的PdCu双金属纳米催化剂。采用XRD、STEM、XPS、HRTEM等对催化剂结构、物相及组成进行表征。结果表明,PdCu/HTs的纳米颗粒尺寸约为2.4nm,分散度达36.7%,形成PdCu合金。在苯甲醇氧化反应中考察PdCu/HTs催化剂的性能,苯甲醇可实现完全转化,苯甲醛产率达97%。
关键词:催化化学;PdCu催化剂;分散性;定位作用;苯甲醇氧化
Pd纳米催化剂因具有丰富的储氢能力[1]和良好的活性被广泛应用于加氢[2]、脱氢[3]、碳碳偶联[4]、电化学[5-6]以及氧化[7-9]等多种催化反应中。单金属Pd催化剂存在负载量高、利用率低、分散性差等缺点。针对这一问题,通常在Pd催化剂中引入第二种金属合成双金属Pd纳米颗粒,降低Pd用量的同时改变Pd原子的电子结构,再结合制备方法的改进控制Pd纳米颗粒的尺寸、表面形貌及分散性等,提高催化剂的催化性能。但是目前双金属催化剂依然存在颗粒尺寸较大、分散性较差等问题。如何改进催化剂的制备方法,获得小尺寸、高分散和高活性的双金属纳米Pd催化剂是催化领域的研究热点。
水滑石作为一种层状化合物,层板上的化学组成和层间阴离子可调控。其结构的可设计性和催化位点的可控性,为制备创新型催化剂或载体提供潜在的机会[10]。
本文利用共沉淀法合成CuMgAl类水滑石(Cu-HTs),以Cu-HTs中高分散的构晶离子Cu2+作为定位剂,利用Cu和Pd之间强的相互作用,定位分散Pd,通过浸渍法制备PdCu双金属纳米催化剂。以苯甲醇的有氧氧化作为探针反应,考察催化剂的催化性能。
1实验部分
1.1水滑石载体制备
通过共沉淀法合成物质的量比分别为0.05∶2∶1、0.1∶2∶1、0.5∶2∶1和1∶2∶1的Cu-Mg-Al类水滑石(记作Cu-HTs)和物质的量比2∶1的Mg-Al水滑石(记为HTs)。金属盐混合溶液中金属离子的总物质的量为0.12mol,浓度为1.5mol·L-1。OH-的物质的量是M2+和M3+总物质的量的2倍,CO2-3的物质的量是M3+物质的量的2倍,沉淀剂Na2CO3和NaOH溶液的浓度均为1.5mol·L-1。
称取0.934gCu(NO3)2·3H2O、19.846gMg(NO3)2·6H2O和14.517gAl(NO3)3·9H2O,溶于80mL去离子水中,得到混合硝酸盐溶液。称取9.6gNaOH溶于160mL去离子水中。称取8.204g无水Na2CO3溶于50mL去离子水,转移至500mL烧杯中。将混合盐溶液和NaOH溶液分别转移至120mL恒压漏斗,同时滴定到Na2CO3溶液中。保持滴加速度一致,并使pH维持在10±0.5,滴加完毕后在60℃下陈化18h。减压抽滤,洗涤至中性,100℃烘箱中干燥过夜。经研磨过筛,得到的蓝色粉末即为物质的量比为0.1∶2∶1的Cu-HTs,其他载体制备步骤类似。本文中如无特殊说明,Cu-HTs和HTs物质的量比分别为0.1∶2∶1和2∶1。
1.2催化剂制备
采用浸渍法制备催化剂。配置10mg·mL-1的PdCl2和Cu(NO3)2前驱体溶液备用。
本文中设计的双金属PdCu催化剂的典型制备步骤如下:取一定量PdCl2溶液及15mL去离子水,与Cu-HTs载体混合均匀,室温条件下搅拌2h,快速蒸干后,100℃下干燥3h,此时得到的样品记为PdCu/HTs-U(未还原的催化剂)。干燥后的粉末在管式炉中H2条件下,以5℃·min-1的速率从室温加热至500℃,恒温还原1h后,冷却至室温,即得到目标催化剂PdCu/HTs。如无特殊说明,Pd的理论负载量为质量分数1%。
采用传统共浸渍法制备PdCu/HTs-C催化剂。相比PdCu/HTs的制备步骤,其不同之处在于,将一定体积PdCl2和Cu(NO3)2溶液同时浸渍到HTs载体上。干燥后未还原时,材料被命名为PdCu/HTs-C-U。如无特殊指明,Pd和Cu的理论负载量分别为质量分数1%和4%。
相关知识推荐:化学催化剂论文发sci期刊容易吗
通过浸渍单一的Pd或Cu金属的前驱体溶液在HTs载体的表面上制备单金属Pd或Cu催化剂。其理论含量和制备步骤同上。当材料未被还原时,单金属Pd催化剂被命名为Pd/HTs-U,单金属Cu催化剂被命名为Cu/HTs-U。在管式炉中通入H2进一步还原后,所得催化剂命名为Pd/HTs或Cu/HTs。
1.3催化剂表征
采用D8Advance型粉末X射线衍射仪分析样品表面晶相。
采用日本KratosAnalyticalLtd公司的多功能成像光电子能谱仪测试元素的价态。
采用FEITecnalG2F20型场发射透射电子显微镜分析样品的形貌、颗粒尺寸及成分和分散情况。
1.4催化剂性能评价
以甲苯为溶剂,十二烷作为内标物,O2作为氧化剂,苯甲醇氧化反应测试催化剂性能。将油浴逐渐升温至110℃,称取催化剂100mg加入到50mL的三口烧瓶中,加入甲苯8mL,苯甲醇1mmol。三口圆底烧瓶的中间口接冷凝回流装置,一边的瓶口用塞子盖住,另一边接入氧气。O2流量为(25~30)mL·min-1,搅拌速率650r·min-1,在设定温度下恒温回流反应。反应结束后,将得到的混合液冷却并转移到25mL容量瓶中,加入0.5mmol十二烷,用甲苯定容,摇匀后采用日本岛津公司GC-2014型气相色谱仪测定组成。
2结果与讨论
2.1XRD
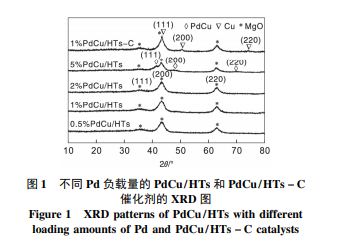
图1为不同Pd负载量的PdCu/HTs和Pd质量分数1%的PdCu/HTs-C催化剂的XRD图。
由图1可知,对于PdCu/HTs催化剂,当Pd的负载量为质量分数0.5%、1%和2%时,仅在35.24°,44.56°,64.82°观察到MgO的标准衍射峰[11]。随着Pd负载量增加到质量分数5%,除MgO的衍射峰外,在41.3°、47.6°和70.1°出现PdCu的合金衍射峰[12-13],只是MgO衍射峰太强掩盖了此峰。41.3°处较强的衍射峰归属为PdCu(111)晶面,47.6°和70.1°处两个较弱衍射峰归属为PdCu(200)和PdCu(220)晶面,这三个特征衍射峰的出现证明PdCu合金的形成。由此可得,当Pd负载量更多时,PdCu合金的衍射峰更明显。对于Pd质量分数1%的PdCu/HTs-C催化剂,除MgO的典型衍射峰外,在43.3°、50.4°及74.1°处出现金属单质Cu的特征衍射峰[14],没有单质Pd或PdCu合金衍射峰的出现,表明PdCu/HTs-C催化剂表面有大量Cu的聚集。相同的Cu含量时,Pd质量分数1%的PdCu/HTs的XRD图中未出现金属单质Cu的衍射峰,表明本实验设计的PdCu/HTs催化剂分散性优于传统共浸渍法制备的PdCu/HTs-C催化剂。
2.2XPS
图2为Pd/HTs、PdCu/HTs-C和PdCu/HTs催化剂中Pd3d轨道的XPS图。
由图2可知,Pd/HTs、PdCu/HTs-C和PdCu/HTs催化剂中Pd3d5/2和Pd3d3/2轨道结合能与标准的Pd0峰值吻合[15],表明Pd元素在经过H2还原后均以零价存在。相比单金属Pd,引入Cu元素后合成的PdCu双金属催化剂中Pd3d轨道偏向结合能更低的方向,即结合能减小,电子密度增大,表明Cu的存在影响了催化剂表面原子Pd的电子结构。
图3为Pd/HTs-U、PdCu/HTs-C-U和PdCu/HTs-U未还原催化剂的Pd3d轨道XPS谱图。
由图3可知,Pd/HTs-U、PdCu/HTs-C-U和PdCu/HTs-U催化剂均出现Pd2+的3d轨道峰。相比单金属Pd,双金属PdCu催化剂中Pd3d轨道的峰值偏向结合能更高的方向,PdCu/HTs-C-U的Pd3d轨道结合能增加0.15eV,PdCu/HTs-U的Pd3d轨道结合能增加0.25eV。表明催化剂中Pd元素在未还原时均以Pd2+存在,且Pd的电子密度减小,电子从Pd转移Cu,Cu的引入改变了催化剂表面Pd元素的电子结构。与PdCu/HTs-C-U相比,PdCu/HTs-U中Pd3d轨道结合能增加更多,电子密度减小更多,表明Pd和Cu元素之间的相互作用力更强。
2.3STEM
图4为Cu/HTs、Pd/HTs、PdCu/HTs和PdCu/HTs-C催化剂的STEM照片和粒径分布。由图4可知,4种催化剂中均有明显可见的颗粒分散在层状载体上。Cu/HTs和Pd/HTs催化剂的平均颗粒尺寸为3.4nm和3.0nm,PdCu/HTs-C的颗粒尺寸为4.2nm,表明在HTs上,共同浸渍Pd和Cu时,得到的双金属PdCu催化剂比单独浸渍Pd或Cu的催化剂颗粒尺寸大。PdCu/HTs的平均颗粒尺寸为2.4nm,比单金属Pd或Cu及双金属PdCu/HTs-C的尺寸小。PdCu/HTs催化剂上Pd分散度计算值为36.7%,PdCu/HTs-C催化剂上Pd分散度仅为20.5%[16],PdCu/HTs显示出更高的分散性。表明本实验中使用的制备方法能够有效控制颗粒的尺寸及分散性。
图5为Pd负载量不同时PdCu/HTs的STEM照片和粒径分布。由图5可知,随着Pd负载量的增加,颗粒的平均尺寸增幅不大,且催化剂中Pd分散度仍较高,表明Pd的负载量增多对PdCu/HTs的颗粒尺寸及分散性影响有限。催化剂均在500℃下还原,未出现颗粒团聚,表明PdCu/HTs催化剂中Pd纳米粒子具有较好的抗烧结能力。
载体中Cu含量对Pd颗粒分散度的影响如图6所示。由图6可知,当载体中Cu2+/Mg2+/Al3+物质的量比小于0.1∶2∶1时,PdCu纳米颗粒在2.4nm以下。随着Cu含量的逐渐增加且Cu2+/Mg2+/Al3+物质的量比超过0.1∶2∶1时,Cu颗粒发生团聚,Cu粒子尺寸增大,PdCu纳米颗粒的尺寸相应增大。表明Cu的分散严重影响Pd纳米颗粒的分散,即Cu的分散对Pd有一定的定位作用。
2.4STEM-EDS
图7为PdCu/HTs和PdCu/HTs-C催化剂的STEM-EDS照片。由图7可知,PdCu/HTs催化剂中Pd和Cu变化趋势是相同的,表明纳米小颗粒中同时含有Pd和Cu元素,且两种元素均匀混合,证明水滑石载体表面有PdCu合金纳米颗粒形成。PdCu/HTs-C催化剂中Pd和Cu混合不均匀,催化剂表面有大量团聚的Cu颗粒,与XRD和STEM结果一致。
2.5HRTEM
图8为PdCu/HTs和PdCu/HTs-C催化剂的HRTEM照片。由图8可知,经测量计算,PdCu/HTs纳米颗粒的平均晶格间距0.222nm,处在Pd(111)晶面间距0.226nm和Cu(111)晶面间距0.209nm间,表明形成PdCu合金的(111)晶面,在纳米颗粒表面形成了高度结晶的PdCu合金层[17]。PdCu/HTs-C纳米颗粒的平均晶格间距为0.225nm,与单金属Pd(111)的晶面间距相似,表明传统共浸渍法制备的双金属PdCu/HTs-C催化剂中Pd和Cu间相互作用较弱,没有形成合金。
2.6PdCu催化剂在苯甲醇氧化反应中的活性
PdCu/HTs和PdCu/HTs-C催化剂的物理特性和在苯甲醇氧化反应中的活性如表1所示。由表1可知,反应时间0.5h时,PdCu/HTs催化剂上苯甲醛收率61%,PdCu/HTs-C上苯甲醛收率仅39%。反应时间3h时,PdCu/HTs催化剂上苯甲醛收率达97%,PdCu/HTs-C上苯甲醛产率仅72%。同样的反应条件下,PdCu/HTs在苯甲醇氧化中的催化活性远高于PdCu/HTs-C,表明本实验中设计的先控制第一种金属的分散性进而诱导第二种金属分散性的制备方法远优于传统的共浸渍法。
2.7催化剂的形成机理通过上述表征分析,推测PdCu/HTs催化剂的形成机理如图10所示。由图10可知,Cu2+掺入HTs中并均匀分布在其层板上。在高温还原过程中,起始还原温度低,催化剂中的Cu2+先被还原为Cu0。还原后Cu和Pd间的强相互作用对负载在载体上的Pd2+起定位分散作用,促使形成了小尺寸、高分散的PdCu合金。
3结论
(1)在MgAl类水滑石中掺入Cu制得Cu-HTs,并以掺杂的构晶离子Cu2+作为定位剂,利用Cu和Pd间的强相互作用,合成小尺寸、高分散的双金属PdCu/HTs催化剂。PdCu/HTs的纳米颗粒尺寸约为2.4nm,分散程度达36.7%,双组份混合均匀,形成了PdCu合金。掺入水滑石中的Cu对Pd具有定位作用,能够有效地分散Pd纳米颗粒。PdCu/HTs-C的颗粒尺寸约4.3nm,分散度20.5%,颗粒团聚现象严重。
(2)以苯甲醇有氧氧化考察催化剂的催化性能。反应时间3h时,PdCu/HTs催化剂上,苯甲醇完全转化,苯甲醛收率达97%,远高于PdCu/HTs-C上的苯甲醛收率72%。——论文作者:符玉绒,许春丽*
转载请注明来自:http://www.lunwencheng.com/lunwen/lig/20826.html