摘要: 本文以左卡尼汀为模型药物, 制备了一种用于治疗初发型干眼病的新型制剂-左卡尼汀温敏原位凝胶。以泊洛沙姆407和泊洛沙姆188为凝胶基质, 透明质酸钠和羧甲基纤维素钠为生物黏附性材料, 采用转子法测定胶凝温度, 星点设计-效应面法优化处方; 并对最优处方的pH值、黏度值及胶凝温度等进行测定, 透析膜透过法考察制剂体外释放, 裂隙灯显微镜观察制剂在兔眼表的滞留性。结果表明, 原位凝胶的最优处方中, 泊洛沙姆 407和泊洛沙姆 188用量分别为 20.81% 和 3.46%, 透明质酸钠为 0.02%, 羧甲基纤维素钠为 0.10%; 室温下 pH 值为 6.90 ± 0.06, 黏度在27 ℃开始发生突跃, 泪液稀释前后的胶凝温度分别为 (26.37 ± 0.06) ℃和 (33.57 ± 0.21) ℃; 体外单位面积释放速率在前240 min内低于溶液剂 (P<0.05), 600 min时累积释放度可达80%以上; 原位凝胶制剂滴眼给药后, 在家兔眼表的滞留时间为25 min左右, 为溶液剂的5倍。动物实验按照国际动物实验指导原则进行并获得北京中医药大学实验动物中心伦理学委员会批准。本文所制得的左卡尼汀温敏原位凝胶性状良好, 具有缓释特性并显著提高了药物在家兔眼表的滞留时间。
关键词: 左卡尼汀; 原位凝胶; 干眼; 高渗; 眼表滞留
左卡尼汀 (levocarnitine, LC) 是一类广泛存在于自然界尤其是动物体内的内源性成分, 其主要功能是促进脂类代谢, 目前上市的剂型有注射液和口服液, 用于治疗慢性肾衰患者因长期血液透析等原因而导致的 LC 缺乏症。近年来, LC 的一些新的药理活性研究逐渐引起人们的重视。有研究表明, LC可减少抗氧化酶的下降和抑制活性氧的产生, 保护人角膜上皮细胞免受高渗性氧化损伤[1] ; 抑制高渗应激下人角膜上皮细胞的炎症反应, 减少干眼病 (dry eye disease, DED) 初发性炎症[2] 。Huo[3] 自制了 LC 滴眼液, 通过一系列实验证实该滴眼液对高渗诱导的 DED 模型小鼠的眼表具有保护作用。2017 年, 国际干眼指南将 LC 列为 DED高渗保护的第一推荐用药[4] , 指出其对 DED的渗透保护效应取决于药物摄取量及保留时间。
近年来, 随着视频显示终端的普遍应用及使用时间延长, DED发病率呈上升及年轻化趋势[5] , 若不及时对该疾病进行干预可能导致 DED 病理性恶性循环[6] , 继发眼部其他疾病, 甚至失明[7] 。目前, 人工泪液是治疗 DED 的主要手段[8] , 但这种疗法仅能暂时性地缓解 DED 症状, 并未针对病因进行治疗, 再加上患者对 DED 初发阶段不重视, 导致其症状逐步发展和恶化。有研究表明, 高渗是DED发生及发展过程中的核心机制[9] , 是诱发角膜炎症和进一步损伤的主要因素之一。在 DED 的初发阶段, LC 等渗透保护剂的及时滴眼使用, 可减轻高渗应激下的角膜损伤及炎症, 抑制 DED 进一步发展, 并纠正局部高渗的眼表微环境, 对眼表具有良好的保护和治疗作用。但由于泪液稀释、鼻泪管引流等原因, 普通滴眼液给药后 6 min 内即迅速消除, 药物生物利用度低[10] 。针对这一问题, 需要设计一种具有生物相容性良好、眼表滞留时间较长并适合于眼部给药的新型递药系统, 包载 LC用于眼部给药, 以期实现其对DED的早期干预和治疗。
原位凝胶作为一种新剂型, 广泛用于缓控释及脉冲释放等给药系统, 且具有多种靶向作用[11] , 与传统的滴眼液相比, 原位凝胶具有如下特点及优势: ① 具有亲水性三维网络结构、含水量高和生物相容性好; ② 与黏膜组织亲和力强、滞留时间长; ③ 经调控可实现药用活性成分不同的释放效果。眼用温敏原位凝胶在室温下为溶液状态, 便于滴眼给药, 给药后因温度升高迅速在眼表发生相转变形成水凝胶, 可延长药物角膜前滞留时间, 有利于药物的释放和吸收。故在本研究中, 作者选择温敏型原位凝胶作为 LC 的递送系统, 采用泊洛沙姆 407 (Poloxamer 407, P407) 和泊洛沙姆188 (Poloxamer 188, P188) 作为凝胶基质, 加入透明质酸钠 (sodium hyaluronate, HA-Na) 与羧甲基纤维素钠 (sodium carboxymethylcellulose, CMC - Na) 等具有保湿增黏效果的辅料, 构建左卡尼汀温敏原位凝胶 (levocarnitine thermosensitive in situ gel, LCTISG), 采用星点设计-效应面法优化处方, 并对最优处方进行一系列质量评价。
材料与方法仪器
ZNCL-S-5D多点智能磁力搅拌器 (河南爱博特科技发展有限公司); Mars40型旋转流变仪 (德国 Haake公司); ZORBAX SB-C18色谱柱 (美国安捷伦科技有限公司); Ultimate 3000 高效液相色谱仪 (美国赛默飞世尔科技有限公司); Y0508型角膜用垂直式扩散池 (口径8 mm)、TK-12D型透皮扩散试验仪 (上海锴凯科技贸易有限公司); 透析膜 (美国 VisKase公司, 截留分子量 3 500); BQ 裂隙灯显微镜 (瑞士 Haag Streit 集团)。
试 剂 P407 ( 批 号 : WPAK592B)、P188 ( 批 号 : WPAK539B) (德国BASF公司); HA-Na (萨恩化学技术有限公司, 批号: CE040040); CMC-Na (上海申光食品化学品有限公司, 批号: 20170724); LC原料药 (东北制药集团股份有限公司, 批号: 0171302002); LC对照品 (成都普思生物科技有限公司, 批号: PS2203-0250MG); 氯化钠 (批号: 20180828)、氯化钾 (批号: 20180518)、碳酸氢钠 (批号: 20170918) (北京化工厂); 二水氯化钙 (天津市光复精细化工研究所, 批号: 20170726); 荧光素钠 (上海源叶生物科技有限公司, 批号: S19S8J44070); 实验用水为纯化水。
实验动物 新西兰兔, 雄性, 普通级, 体重 2.3~ 2.5 kg, 北京金牧阳实验动物养殖有限责任公司提供, 许可证号: SCXK (京) 2015-0005。动物实验按照国际动物实验指导原则进行并获得北京中医药大学实验动物中心伦理学委员会批准。
泊洛沙姆溶液的制备 采用冷溶法[12] 制备泊洛沙姆溶液。称取 P407 或/和 P188 适量, 加入一定量的磷酸盐缓冲液, 同一方向搅拌至泊洛沙姆颗粒充分分散和润湿, 形成较为均匀的混悬液; 将该混悬液置于4 ℃ 冰箱中冷藏24 h, 至形成澄清透明的溶液, 即得。
胶凝温度的测定 采用搅拌子法[13] 测定胶凝温度。取适量待测溶液置于烧杯中, 加入转子, 调节磁力搅拌器转速为 100 r·min-1 , 保持水浴以 (0.5~1.0) ℃·min-1 的速度持续升温, 记录转子停止转动时的温度, 即为胶凝温度。泪液稀释前 (即凝胶本身) 的胶凝温度记为 T1, 泪液稀释 (即凝胶与泪液以 40∶7[14] 比例混合) 后的胶凝温度记为T2。
左卡尼汀温敏原位凝胶的制备 称取处方量 HA-Na 及CMC-Na, 加入适量纯化水, 搅拌分散并使之完全溶胀; 加入处方量 P407 及 P188, 搅拌使分散均匀, 并放入4 ℃冰箱中冷藏24 h以上, 至溶液澄清透明后, 加入处方量 LC, 补加纯化水至全量, 搅拌均匀, 即得LCTISG。
模拟泪液的制备 模拟泪液 (simulated tear fluid, STF) 制备方法如下[15] : 取碳酸氢钠 2.18 g、氯化钠 6.78 g、二水氯化钙 0.084 g 和氯化钾 1.38 g, 加纯化水 1 L, 搅拌均匀并超声使全部物质溶解, 即得。
星点设计-效应面法优化处方 采用星点设计法, 选择P407浓度 (X1)、P188浓度 (X2)、HA-Na与CMC-Na 浓度 (X3) 作为考察因素, 其中固定 HA-Na与 CMC-Na 的浓度配比为 1∶5, X3值表示1/6的HA-Na与CMC-Na 浓度之和。根据文献报道[16,17] 和单因素试验结果确定 X1、X2 和 X3 范围, 考察指标为 T1 和 T2, 采用 DesignExpert软件设计试验并对结果进行多元回归拟合。为达到眼用温敏原位凝胶的保存和使用要求, 将 T1控制在 26 ℃~30 ℃内, T2控制在 30 ℃~34 ℃内[18] , 得到优化区域。从优化区域中选择几个具有代表性的处方, 制备 LCTISG, 测定 T1及 T2, 并计算偏差: 偏差=(预测值-实测值)/预测值×100%, 验证星点设计的可靠性和合理性, 并选择最优处方。
制剂外观观察 在 25 ℃和 34 ℃时观察制备的 LCTISG外观及流动性。
制剂 pH 值测定 取 LCTISG 5 mL, 加入 5 mL 新沸并放冷至室温 (25 ± 2) ℃的纯化水, 搅拌均匀, 室温下测定其pH值。
制剂黏度测定 控制旋转流变仪 (转子类型: 20 mm 平板) 的剪切速率为 1.0 1 ·s-1 , 升温速率为 1 ℃·min-1 , 测定 LCTISG 在 20 ℃~35 ℃内的黏度值, 作黏度-温度变化曲线。
左卡尼汀含量测定方法色谱条件 色谱柱: ZORBAX SB-C18 (250 mm× 4.6 mm, 5 µm); 流动相: 甲醇-磷酸盐缓冲液 (取磷酸 10 mL, 加水 1 900 mL, 用 1 mol· L-1氢氧化钠溶液约 l00 mL调节 pH值至 2.4, 加庚烷磺酸钠1.1 g) = 15∶85; 检测波长: 225 nm; 柱温: 25 ℃; 流速: 1.0 mL·min-1 ; 进样量: 20 µL。
溶液的制备 对照品贮备液的制备: 取 LC 对照品约50 mg, 精密称定, 置50 mL量瓶中, 加水溶解并稀释至刻度, 摇匀, 制成约含 LC 1 mg · mL-1的溶液, 即得; 对照品溶液的制备: 精密移取对照品贮备液 2.0 mL, 置 10 mL 量瓶中, 加释放介质稀释至刻度, 摇匀, 制成约含LC 200 µg·mL-1的溶液, 即得; 供试品溶液的制备: 精密移取LCTISG 2 mL(约相当于LC 20 mg), 置 100 mL量瓶中, 加释放介质稀释至刻度, 摇匀, 制成约含 LC 200 µg ·mL-1的溶液, 4 950 r· min-1离心 20 min, 取上清液, 即得; 阴性样品溶液的制备: 制备不含药空白温敏原位凝胶, 其余按照上述供试品溶液的制备方法制备样品, 即得。释放介质的制备: 称取氯化钠 6.78 g、二水氯化钙 0.084 g 和氯化钾 1.38 g, 加纯化水 1 L, 搅拌均匀并超声使全部物质溶解, 即得。
专属性 取对照品溶液、供试品溶液及阴性样品溶液, 分别按色谱条件进行检测。稳定性 取对照品溶液, 按色谱条件进样, 分别在 0、2、4、6、8 和 10 h 进行检测, 记录色谱峰面积, 计算 RSD值。精密度 取对照品溶液, 按色谱条件连续进样 6 次, 记录色谱峰面积, 计算RSD值。
线性范围 精密移取对照品贮备液, 分别制成质量浓度约为 10、100、200、300 和 400 µg ·mL-1系列 LC 溶液。上述LC溶液分别按色谱条件进行检测, 记录色谱峰面积, 以峰面积对浓度作线性回归, 得回归方程。重复性 平行制备 6份 LCTISG, 再分别配制 1份供试品溶液, 按色谱条件进行检测, 记录色谱峰面积, 计算LC的平均质量浓度及RSD值。回收率 分别精密移取对照品贮备液 1.6、2.0 和 2.4 mL, 加入 10 mL 量瓶中(每个浓度点平行制备 3 份), 再分别加入空白温敏原位凝胶 200 µL, 加释放介质稀释至刻度, 摇匀, 配制成 80%、100% 和 120% 规格浓度的待测溶液, 4 950 r·min-1离心 20 min, 取上清液, 按色谱条件进行检测, 记录色谱峰面积, 计算 LC平均加样回收率及RSD值。
体外释放度考察 左卡尼汀溶液剂 (levocarnitine solution, LCS) 的制备: 取 LC 1.00 g, 精密称定, 置于 100 mL 量瓶中, 加 0.9% 氯化钠溶液溶解并稀释至刻度, 摇匀, 即得。将预处理好的透析袋剪开得到透析膜, 固定在角膜扩散池的样品池与接收池之间; 分别加入 0.2 g LCTISG和LCS, 精密称定; 向接收池中加入34 ℃ 的释放介质, 然后将整个装置置于温度为 (34.0 ± 0.5) ℃、搅拌子转速为 100 r·min-1的透皮扩散仪中进行释放; 在预定的时间 10、25、40、60、90、120、180、240、360、 480和600 min取接收池中释放介质1 mL, 并补加等量同温度释放介质, 取出的样品直接过 0.22 μm 微孔滤膜, HPLC测定LC浓度。计算LC累计释放度, 以累积释放度对时间作图, 得到药物体外释放曲线, 累积释放度 (F) 计算公式如 (1), 其中 Ct为 t时刻药物测定浓度, V0为接收池释放介质体积, V 为取样体积, Ci为 t 时刻前药物测定浓度, C0 (w/w) 为制剂中药物浓度, m为制剂加样量。 F = Ct V 0 + V∑Ci C0 ⋅ m (1) 对 LCS 和 LCTISG 体外释放数据进行几种常用数学模型[19] 的拟合, 即零级方程: F = Kt; 一级方程: ln(100-F) = -Kt; Higuchi 方程: F = Kt1/2 ; Ritger-Peppas 方程: lnF = Klnt + C。其中F表示t时刻的累积释放度, K表示释药常数, t表示取样时间, C为释放速率常数。家兔眼表滞留性实验 荧光素钠温敏原位凝胶的制备: 同 LCTISG 的制备方法; 荧光素钠溶液剂的制备: 同 LCS 的制备方法。取健康家兔, 腹腔注射 10% 水合氯醛 (3.2 mL·kg-1 ) 麻醉后, 左眼滴入荧光素钠温敏原位凝胶20 µL, 右眼滴入荧光素钠溶液剂 20 µL作为对照; 给药后使兔眼被动闭合 10 s, 开始计时, 在预定的时间 1、3、5、10、15、20和 25 min, 用裂隙灯钴蓝光观察兔眼角膜表面连续荧光层, 荧光层消失时间即为眼表滞留时间[20] 。统计学分析 数据以 xˉ ± s表示, 两组间数据比较采用 Student's t 检验, 当 P<0.05 时表示差异具有统计学意义。
结果
1 左卡尼汀温敏原位凝胶处方优选
1.1 单因素试验
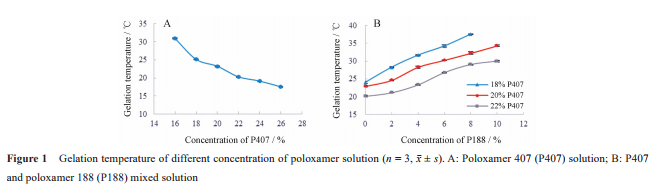
P407是制备温敏原位凝胶的常用基质, 有研究表明, 浓度小于 15% (w/v) 的 P407溶液无法形成凝胶[21] , 而浓度高于 30% 在 4 ℃下就会形成凝胶[22] 。因此, 通过单因素试验, 考察 P407 浓度与胶凝温度的相关性, 并筛选合适的浓度范围进行后续的处方优化。实验中制备了浓度分别为 16%、18%、20%、22%、24% 和 26% 的一系列 P407 溶液, 并测定其胶凝温度, 结果见图 1A。随着 P407溶液浓度的增大, 胶凝温度降低, 当浓度>18% 时, 胶凝温度低于 25 ℃, 不利于其制备和使用。通常可加入其他辅料如P188与之配伍使用, 从而提高胶凝温度, 并克服单独使用P407时存在的机械强度低和生物黏附性差等[23,24] 缺点。在本实验中, 分别固定 P407 浓度为 18%、20% 和 22%, 并加入 0%、2%、 4%、6%、8% 和 10% 系列浓度 P188, 进行单因素考察, 测定胶凝温度, 结果见图1B。P188溶液在浓度0%~10% 内, 随着浓度的增大胶凝温度升高。为满足制剂在室温下为流动性液体 (T1>25 ℃)、在眼部能胶凝 (T2<34 ℃) 及辅料量使用量低等条件, 采用星点设计优化处方时, 选择P407浓度在16%~22%内, P188在0%~8%内。
1.2 生物黏附性材料
滴眼液常用的增黏剂有卡波姆940、羧甲基纤维素 (carboxymethylcellulose, CMC)、透明质酸 (hyaluronic acid, HA) 及羟丙甲纤维素等, 其中 HA 被称为理想的天然保湿因子, 可稳定泪膜、防止角膜干燥、减轻眼组织摩擦及缓解 DED[25] , 在保湿的同时又是良好的促透剂; CMC 可促进角膜上皮细胞愈合, 用于轻度及中度 DED的治疗。有研究表明, 与单独给予CMC或HA相比, CMC与HA联合给药对小鼠DED模型治疗效果更优[26] 。此外, 已上市用于缓解DED的透明质酸钠滴眼液 、羧甲基纤维素钠滴眼液或 CMC 与 HA 联用制剂, 如 Optive FusionTM, 上述制剂中 HA-Na和 CMC-Na 常用浓度分别为 0.1% 和 0.5%。因此, 选取 HA-Na 及 CMC-Na 作为生物黏附性材料, 固定 HA-Na 与 CMCNa 的配比为 1∶5, 选择 HA-Na 浓度在 0%~0.1% 内, CMC-Na在0%~0.5%内。
1.3 星点设计-效应面法优化处方
1.3.1 试验设计
采用星点设计试验, 因素及水平见表 1, 试验方案及结果见表2。
1.3.2 方程拟合
对实验结果进行多元回归拟合, 拟合方程如下: T1 = 6.03+3.86X1+4 363X2+133.03X3-0.10X1X2- 9.88X1X3+6.84X2X3-0.15X1 2 -0.22X2 2 +74.15X3 2 (R2 = 0.980 2, CV = 3.35%, P<0.000 1) T2 = 137.67-5.20X1-11.78X2+408.77X3+0.63X1X2- 21.99X1X3-1.41X2X3 (R2 = 0.981 9, CV = 2.26%, P<0.000 1) 由上述方程可知, 模型拟合优度 (R2 ) 均良好, 拟合方程均具有显著性, 可采用该方程对 T1及 T2进行预测。
1.3.3 重叠等高线法进行处方优化
通过Design-Expert软件, 采用重叠等高线法对所得到的星点设计试验数据进行分析处理, 根据制剂特点来确定各指标的优化目标, 并寻找优化的处方范围。所得到的优化区域见图2黄色区域。
1.3.4 优化处方的验证
从上述优化区域中, 选择 3 个具有代表性的基质处方, 即基质处方 1: P407 22.41%、P188 5.37%、HA-Na 0.10%、CMC - Na 0.50%; 基 质 处 方 2: P407 20.92%、 P188 3.14%、HA-Na 0.00%、CMC-Na 0.00%; 基质处方 3: P407 20.81%、P188 3.46%、HA -Na 0.02%、CMC-Na 0.10%。并按前述方法制备 LCTISG, 测定其 T1 和 T2 值。各处方测定结果见表3。结果表明, 处方2及处方3 的T1和T2偏差均<5.00%, 上述拟合方程的预测结果较好。处方 2 及处方 3 能够满足 T1>25 ℃, T2<34 ℃的基本要求, 因 HA-Na及 CMC-Na既可以增加药物的眼部滞留时间又可以起到DED辅助治疗效果, 综合考虑将处方3确定为最优处方。
2 左卡尼汀温敏原位凝胶质量评价
2.1 外观
本文制备的LCTISG在25℃时为可流动的透明液体, 在 34℃时形成了透明的半固体状凝胶, 符合理想的眼用制剂应透明这一要求。
2.2 pH值
人体正常泪液的pH值为7.4, 眼睛可耐受的pH值范围为 5.0~9.0, 在 6.0~8.0内无不舒适感, pH值过高或过低将会刺激眼球, 增加泪液分泌量, 导致药物迅速流失, 甚至损伤角膜。LCTISG 的 pH 值为 6.90 ± 0.06 (n=3), 符合眼用制剂pH值要求。
2.3 溶液黏度
适当增大滴眼液黏度, 可延长药物眼部滞留时间, 减少刺激性, 从而提高疗效。LCTISG的黏度-温度变化曲线见图 3, 由图可知, 其黏度在 27 ℃开始发生突跃, 表明制剂在27 ℃左右开始发生相转变形成凝胶。
2.4 体外释放实验
2.4.1 左卡尼汀含量测定方法
2.4.1.1 专属性 LC保留时间约为4.5 min, 结果见图 4。阴性样品中无 LC 色谱峰出现, 表明 LCTISG 中其他成分及释放介质对LC含量测定无干扰。
2.4.1.2 稳定性 LC 峰面积的 RSD 值为 0.70%, 表明 LC在释放介质中10 h内的稳定性良好。
2.4.1.3 精密度 LC 峰面积的 RSD 值为 0.34%, 表明仪器精密度良好。
2.4.1.4 线性范围 回归方程为: y = 0.002 5x + 0.000 2 (R2 = 0.999 9), 表明 LC 在 10.16~406.40 µg ·mL-1内与峰面积的线性关系良好。
2.4.1.5 重复性 制剂中 LC 的平均质量浓度为 9.61 mg·mL-1 , RSD值为1.20%, 表明该方法重复性良好。
2.4.1.6 回收率 LC 的平均加样回收率为 100.51%, RSD值为1.54%, 表明该方法回收率符合要求。
2.4.2 体外释放度考察采用透析膜法, 对比了 LCS 和 LCTISG 的体外释放情况, 药物释放曲线见图 5。LCS 和 LCTISG 在 600 min时的累积释放度分别为 (76.83 ± 3.04)%和 (82.96 ± 1.80)% , 二者结果无显著性差异 (P>0.05)。LCS 和 LCTISG 在前 240 min 内的单位面积释放速率分别为 (12.63 ± 0.29) 和 (11.40 ± 0.14) µg·(min·cm2 ) -1 , LCS的释放速率显著高于 LCTISG (P<0.05)。随着体外释放时间的延长, 接收池和样品池中药物浓度差逐渐减小, 最终将处于平衡状态。多次体外释放试验发现, 二者制剂的平衡累积释放度均为 80% 左右, 是否由于释放装置或透析膜对药物产生了一定的吸附, 从而造成了药物未达到 100% 释放, 还有待进一步的探讨。在目前的情况下, 对二者 360 min 内的体外释放数据进行了模型拟合, 各方程拟合结果见表 4。由拟合结果可知, LCTISG 释放曲线更符合 Ritger-Peppas 方程, 在此方程中, 当 0.45量, 故确定为 20 µL。家兔给予荧光素钠溶液剂 20 µL 后, 1 min时结膜囊内可见荧光呈环形围绕; 3 min后荧光明显减弱, 表明大量溶液被稀释并排除; 5 min后荧光彻底消失。而荧光素钠温敏原位凝胶滴入兔眼后, 立即在眼表发生相转变形成凝胶, 由于眨眼反射及泪液稀释, 温敏凝胶大部分被带入结膜囊内, 在眼部的滞留时间可达 25 min 左右。因 HA-Na 可亲和吸附大量水分, 家兔分泌的大部分泪液可被 HA-Na吸附并暂时停留在眼表, 可见荧光体积变大, 荧光明显。
讨论
在DED的初发阶段, 高渗是其最典型的病因和病症, LC 作为国际泪膜与眼表协会 DED 诊疗指南中用于DED高渗保护的第一推荐用药, 其对于高渗状态下角膜上皮细胞的保护作用已得到充分验证。本文选择了LC作为早期DED的治疗用药, 通过星点设计-效应面法优选了 LCTISG 的处方, 并制备得到了具有良好眼表滞留性的 LC 眼用递药系统。该系统具有适宜的 pH值和黏度; 在25 ℃以下温度呈液体状态, 有利于其制备、储存及定量滴眼给药; 滴眼给药后, 在家兔眼部迅速凝胶化, 覆盖于眼表区域, 有利于药物在眼表停留和进一步的吸收。温敏原位凝胶递药系统一方面可充分发挥直接眼表给药的优势; 另一方面又能克服滴眼液需频繁给药的弊端, 有助于延长药物在眼表的停留时间, 提高药物生物利用度。但LCTISG中凝胶基质可能引起眼部刺激性等问题, 且体外实验不能准确反映药物在体情况, 因此关于该制剂的眼部刺激性、药效学及药代动力学等实验有待进一步研究, 以期能全面评价该递药系统的性能, 为LC新型眼用制剂的新药研究奠定基础及其他 DED 治疗药物的发现和剂型设计提供一定的参考和借鉴。
References
[1] Khajavi N, Reinach PS, Skrzypski M, et al. L-Carnitine reduces in human conjunctival epithelial cells hypertonic-induced shrinkage through interacting with TRPV1 channels [J]. Cell Physiol Biochem, 2014, 34: 790-803.
[2] Hua X, Su ZT, Deng RZ, et al. Effects of L-carnitine, erythritol and betaine on pro-inflammatory markers in primary human corneal epithelial cells exposed to hyperosmotic stress [J]. Curr Eye Res, 2015, 40: 657-667.
[3] Huo J. A Primary Study of L-Carnitine Protective Effect on Ocular Surface of Mouse Dry Eye Model Induced by Hyperos‐ molar Saline (左卡尼汀对高渗盐水诱导的小鼠干眼模型眼表保护作用的初步研究) [D]. Chongqing: Third Military Medical University, 2012.
[4] Jones L,Downie LE, Korb D, et al. TFOS DEWS II management and therapy report [J]. Ocul Surf, 2017, 15: 575-628.
左卡尼汀温敏原位凝胶的制备及质量评价相关论文期刊你还可以了解:《中药凝胶剂研究》
转载请注明来自:http://www.lunwencheng.com/lunwen/yix/14721.html