摘要:切伦科夫光是放射性核素衰变过程中的发光现象, 在生物医学领域受到越来越多的关注。 切伦科夫光的可见光波段可以直接被相机捕获实现切伦科夫成像, 有望运用于术中导航。 同时, 切伦科夫光在此过程中作为体内光源的性质也受到关注, 将核素作为体内光源结合纳米颗粒进行光动力治疗可以取得较好的肿瘤抑制性。 但是由于切伦科夫光的发光效率极低, 相关研究仍存在争议, 其可能并不是仅有切伦科夫光起作用的结果。 虽然切伦科夫光在生物医学领域具有独特运用, 但其较低的发光效率是限制其发展的关键因素。 基于纳米颗粒-核素相互作用的体系则可解决这一问题, 为进一步拓展切伦科夫光在生物医学研究中的应用奠定基础。
关键词:切伦科夫光;纳米药物;放射性核素;诊疗一体化;光动力治疗
切伦科夫 光(Cherenkov /Cerenkov li ght , CL)是指当带电粒子(如电子)的速度超过介质中光速时,介质被激发产生的电磁辐射,也被称为瓦维洛夫-切伦科夫光(Sergey Vavilov-Cherenkov light)。早在 1888 年, 物理学家 Oliver H eaviside 提出了一个预测性的理论 :带电粒子以大于光的相速度运动时 ,其与介质的相互作用会导致发光。在此之后,许多核物理学家在此方面做出了许多贡献。其中 , 苏联科学家切伦科夫是第一个通过实验检测它的人,因此荣获 1958 年诺贝尔奖,并以其名字命名这种辐射。
1 切伦科夫光产生的原理
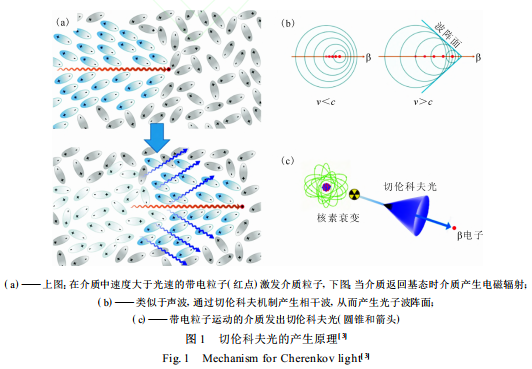
在真空中,粒子的运动速度必然小于光速;但在介质中,光速会由于介质的影响而下降,导致粒子的运动速度可以高于介质中的光速。切伦科夫光的产生原理示于图 1 。带电粒子在介质中运动时,介质会被带电粒子极化而激发至激发态,随后又通过弛豫回到基态并放出电磁波[ 1-2] (图 1(a) [ 3] )。由于带电粒子的运动速度(v)大于介质中的光速 (c) , 即介质产生的电磁波的传播速度小于粒子的运动速度 ,基于惠更斯原理(图 1(b) [ 3] ), 电磁波发生相长干涉形成连续的电磁波谱, 并沿着粒子运动方向的一定夹角发出 。这一原理与音爆产生的原理相同。
切伦科夫光是由带电粒子运动的介质发出而不是带电粒子本身(图 1(c) [ 3] )。β 核素产生切伦科夫光的根本条件是 β 粒子能量大于切伦科夫阈值(261 keV(水中))。切伦科夫光的强度根据 F rank-T amm 公式[ 4] 给出 : dN dx =2πα1 - 1 β 2 n 2 ∫ λ2 λ1 1 λ2 dλ 式中 :dN /dx 为光子通量, 它取决于所研究的波长(λ1 、λ2)、带电粒子的初始动能和带电粒子通过材料的折射率(n);α为精细结构常数 , α=e 2 / (4πε0)h - c , e 是电子电荷,ε0 是真空中的介电常数, h - 是约化普朗克常数;β 为带电粒子与光在介质中的相对速度, β =v /c。切伦科夫光在紫外-可见光区呈连续光谱 ,光强以 1 /λ 2 关系减小 ,而在X 射线及以下的短波段由于介质折光率的下降(n <1)造成带电粒子无法超过介质光速而无法产生切伦科夫光 , 因而切伦科夫光主要集中在紫外-蓝光区[ 5] 。在过去,切伦科夫光的相关研究主要集中在其物理性质及材料性能方面, 如检测宇宙中的伽马射线与强子射线等宇宙粒子或使用发射的切伦科夫光的角度进行粒子速度计算。近年来也有少量研究报道关注于将切伦科夫光用于活体成像[ 6] 与光动力治疗(PDT) [ 7-8] , 而纳米药物科学则成为其重要的应用方向。
2 切伦科夫成像
2009 年 , Robertson 等[ 6] 在注射了临床放射性示踪剂的动物体内首先观察到切伦科夫光, 随后开发了切伦科夫成像技术。在此之后 ,许多科学家研究了不同医用放射性核素的切伦科夫成像的特征[ 9-11] 。因此 ,借助切伦科夫成像技术 ,同一放射性核素探针可以提供两种独立的成像模态 (光学和正电子发射断层扫描(PE T)成像)。切伦科夫成像与传统的 PET 成像相比, 具有一定的优势[ 3] :(1) 光学相机比昂贵的核成像仪器更具成本效益;(2) 切伦科夫成像的成像时间更短; (3) 切伦科夫成像可以对常规活体核成像手段 (PE T 、单光子发射计算机断层成像(SPECT))无法成像的核素进行成像 , 如90 Y [ 12] 或225 Ac [ 13] (具有β 发射子体的 α发射体)。由于 18 F等放射性核素常用于癌症诊断 , 因此切伦科夫光的医学应用研究主要集中在肿瘤学研究中 。 但是切伦科夫成像同样存在一定的缺陷 :(1) 切伦科夫光在紫外光区强度高而在长波区强度迅速减小 , 通过光学扫描仪得到了体外的 100 μCi(3. 7 MBq) 18 F-FDG 或 89 Zr 的切伦科夫光的定量光谱 , 其符合 Frank-Tamm 方程所预期的特征 1 /λ2 谱(图 2(a)) [ 3] ;体内切伦科夫成像时 , 可以看到高频光子的衰减 , 小鼠膀胱中 18 F-FDG 的切伦科夫光谱在红光及近红外区域有最大吸收 ,而89 Zr的切伦科夫光则在短波区表现出较强的吸收(平均值±标准差 , n =4) (图 2(b)) [ 3] , 由于组织对短波光子有较强的吸收与散射 , 短波波谱衰减显著 , 因此难以检测到几厘米深处的切伦科夫光 ;(2) 切伦科夫光比环境光的强度低约 10 亿倍 [ 14] , 这意味着在成像时需要阻挡环境光 , 并且需要数分钟的采集时间 。
放射性核素与纳米粒子结合使用在一定程度上可以解决第一个问题[ 14 1 5] 。纳米粒子通常具有光致发光的特性 , 放射性核素衰变产生的切伦科夫光与纳米粒子相互作用可以产生长波辐射(图 3(a))。由图 3(a)可知 , 从正电子-荧光纳米粒子系统获得三个信号 :切伦科夫光 、红移荧光和 PET 信号 , 而高能电子-纳米颗粒系统仅产生切伦科夫光和红移荧光 。切伦科夫光-荧光纳米粒子系统可大致分为三类 :与纳米粒子分离的切伦科夫发射体 、与纳米粒子表面结合的发射体和纳入纳米粒子晶格的发射体(图 3(b))。当将纳米粒子与放射性核素结合用于切伦科夫成像时 ,需要考虑到放射性核素的切伦科夫光强度等因素。如果需要高强度的切伦科夫光 ,则 68 Ga或 90 Y等放射性示踪剂优于 18 F或 64 Cu ;如果需增加切伦科夫光的深度渗透, 则应优选具有被蓝光激发的高量子产率的光致发光纳米颗粒 ,并且发射光谱处于红光或近红外光区域(其中组织吸收性较低)。
3 基于切伦科夫光的光动力治疗
光动力治疗(PDT)已成为生物医学研究的新前沿 。在典型的 PDT 中 ,光敏剂需要由外部光源激活 ,但由于常规光源(波长 400 ~ 800 nm)容易被生物组织吸收和散射[ 16] ,深层肿瘤的治疗效果并不理想 , 必须借助纤维光源 [ 17] 。为此, 医生与科学家们提出使用化学/生物发光系统:将化学/ 生物发光作为内部光源来解决光的组织穿透能力不足的问题[ 18] 。基于放射性示踪剂的 PET 成像是一种活体全身成像技术 ,与其他光学成像方式相比没有组织深度的限制 [ 19] , 可以提供肿瘤大小和位置的信息 , 通过图像引导治疗[ 20] 。在 PDT 治疗中, PET 成像技术可以对 PDT 治疗效果进行评价 , 设计 PDT 治疗时间 [ 21] 。因此, PE T 和 PDT 的组合可能成为治疗癌症的绝佳方法之一。 2015 年 ,华盛顿大学的 Samuel Achilefu 及其同事报道了利用放射性核素产生切伦科夫光作为光源,激发二氧化钛纳米颗粒实现 PDT 治疗 ,打破 PDT 光源穿透深度限制的方法[ 22-23] (图 4)。从放射性核素的衰变中发出的切伦科夫光被用作内部光源以激活充当纳米光敏剂的二氧化钛纳米颗粒, 活化的二氧化钛纳米粒子产生羟基自由基 ( OH)诱导局部细胞凋亡 [ 24] 。
Achilefu 及其同事使用用于肿瘤 PE T 成像的 64 Cu 作为 PDT 光源 [ 22] 。将聚合物包被的纳米光敏剂和64 Cu 正电子发射体共同注射至侵袭性纤维肉瘤肿瘤中 ,在 30 d 内观察到小鼠肿瘤完全图 4 切伦科夫辐射诱导治疗示意图[23] Fig. 4 Schematic diagram of Cher enkov radiation-induced therapy [ 23] 消退 ,而纳米光敏剂和非放射性“冷” 铜的共注射不会导致任何治疗后果。但由于临床上药物难以通过局部注射的方法直接作用于肿瘤部位 ,该方法受到较大的限制。聚合物包被的二氧化钛纳米光敏剂不具有肿瘤靶向性, Achilefu 随后开发了可与肿瘤细胞膜上高表达的转铁蛋白受体相结合的去铁转铁蛋白修饰的第二代粒子, 最后用去铁转铁蛋白携带二茂钛作为额外的光引发剂以提高功效[ 22] 。去铁转铁蛋白包被的纳米光敏剂和18 F氟脱氧葡萄糖( 18 F-FDG)均以静脉注射的方式注射到小鼠体内 ,去铁转铁蛋白修饰的纳米光敏剂和 18 F-FDG 均在肿瘤具有高摄取 ,进而无须任何外部光源即实现 PDT 。而使用具有二茂钛的纳米光敏剂可以增大对肿瘤的治疗效果 , 从而实现对肿瘤的“双重打击” 。同时, 使用具有靶向性的临床放射性示踪剂作为内部光源, 可以将 PDT 扩展到多转移性疾病。与传统 PDT 中的外照射相比,放射性核素的切伦科夫光通量(nJ/cm 2)远小于传统 PDT 的总光通量(mJ/cm 2 ) [ 24] 。因此该策略具有很高的应用前景 ,然而仍有待进一步探讨 PDT 激发中放射性核素(较长时间 、较低光子通量)与外部光束(较短、高强度激发)之间的差异 [ 25] 。提高 PDT 效率的关键途径是探索产生更多切伦科夫光的放射性核素及符合切伦科夫光光谱的光敏剂。
蔡伟波课题组利用中空的介孔二氧化硅纳米粒子(HMSNs)载带二氢卟吩(Ce6), 并使用氧化锆-89(T1 /2( 89 Zr) =78. 4 h)进行放射性标记, 实现了高效 PDT , 使得 Ce6 可以在同一个纳米结构中通过 89 Zr的切伦科夫光激活 [ 26] 。体外细胞活性实验中证明细胞死亡率与 Ce6 和89 Zr浓度成正相关的函数关系 。体内研究表明:当小鼠皮下注射 8 9 Zr-HMSN-Ce6 时, 肿瘤生长受到抑制 , 肿瘤切片的组织学分析显示肿瘤组织受损, 这意味着活性氧物质介导了这种损伤。同时, 放射性标记的 8 9 Zr-HMSN-Ce6 纳米结构也可用于 PET 图像引导的 PDT 。
与Achilefu 的研究[ 22] 相比,蔡伟波使用了更长半衰期(T1 /2( 89 Zr)=78. 4 h)与更高能量(909 keV)的 β 发射体89 Zr作为切伦科夫光源激发 Ce6 , 以产生活性氧物种。Ce6 具有在 400 nm 处达到峰值的强吸收带 ,其与89 Zr的切伦科夫光谱相匹配, 增大了能量转换效率 。但是89 Zr-HMSN-Ce6 纳米粒子在肝脏中的大量富集将导致严重的肝损伤, 需要进一步改良与优化 。刘志博课题组用68Ga作为切伦科夫光源激发葡聚糖修饰的 TiO2 纳米颗粒(D-TiO2 NPs), 实现了切伦科夫光介导的光动力治疗[ 27] 。与18 F相比, 68 Ga介导的光动力治疗能更好地抑制 4T1 细胞生长,并显示出更强的 DNA 损伤 。体内研究表明 ,当用 D-TiO2 NPs 和68Ga-BSA 的组合处理荷瘤小鼠时, 肿瘤生长几乎被完全抑制 。该研究证明 , 68Ga是一种比18 F更有效的 PDT 切伦科夫光光源,而且68Ga的优势在于其切伦科夫光生产率比 18 F高约 20 倍;此外 , 68 Ga标记的 PET 示踪剂 如 68Ga-PSMA [ 28] 、 68Ga-DOTA-TATE [ 29] 和 6 8Ga-DOTA-TOC [ 30] 已广泛用于癌症诊断 , 并且对肿瘤靶向具有高度特异性;而且 68 Ga很容易从 6 8 Ge / 68 Ga发生器获得,而无需通过回旋加速器生产,更加方便临床医疗以及科学研究[ 31] 。
4 基于切伦科夫光的光动力治疗的争论
但在 2018 年 , 斯坦福大学医学院的 Pratx 等[ 32] 指出以上研究结果只能表明放射性核素和光敏剂以协同方式相互作用, 增加了对肿瘤的治疗效果,但它们并未证明这种相互作用是通过切伦科夫光产生的 。因为切伦科夫发光是一种非常微弱的现象 [ 25] , 常用的 18 F在纯水中(折射率 n = 1. 33)衰变一次平均发射 1. 32 个光子[ 3] 。就能量而言 ,切伦科夫光占18 F放射性衰变期间释放总能量的不到 0. 006 %,绝大部分能量(>99. 99 %)通过分子激发、电离、韧致辐射和热量消散 。而单个 1 8 F衰变(Eβ + ≈250 keV)通过水的辐解产生6 800 个羟基自由基( OH) [ 33] , 这些电离辐射产生的 OH可能在与 DNA 的相互作用中起主要作用。若认为切伦科夫光在肿瘤细胞的凋亡中起主导因素,其对 DNA 的作用必须与 6 800 个 OH 相当或更大。然而 , 由于 TiO2 的带隙(3. 2 eV), 1. 32 个光子无法产生超过两个 OH 。Pratx 认为观察到的细胞凋亡可能是正电子与 TiO2 纳米颗粒直接相互作用所产生, TiO2 纳米颗粒只是一个放疗增敏剂。
Achilefu 教授对此进行了发文回应[ 34] 。他指出 β 衰变的放射性核素与半导体如 TiO2 等光催化剂的相互作用可能涉及许多过程, 包括: (1) 通过电离辐射对大量水进行辐解, 产生电子和 OH ;(2) 通过放射性能量转换在 TiO2 中产生电子和空穴对 [ 35] ;(3) 通过切伦科夫发光和其他发光现象的能量转移在 TiO2 中产生电子和空穴对 。通过控制 18 F-FDG 剂量 ,确保 18 F辐射不会在不存在 TiO2 的情况下导致任何可观察到的生物效应 。使用 H T1080 肿瘤模型,在高达30 MBq 时未观察到肿瘤负荷的减少。可以排除途径(1) 的原因。在上述途径(2)和途径(3)中 , 通过催化作用可以在固-液界面上产生过氧化氢、单线态氧、羟基自由基和超氧自由基 [ 36-3 7] ,这些自由基的累积效应会诱导肿瘤细胞凋亡 。通过一个简单的模型计算 , 肿瘤体积为 50 mm 3 累积的 18 F-FDG 剂量为 1. 6 MBq(约为注射剂量的 5 %), 核素完全衰变将产生约 500 亿光子, 在肿瘤区域内可以产生较大的局部光子密度, 平均每个细胞接收 1 000个光子 ,将激活大量的 TiO2 纳米颗粒, 可以产生足够多的活性氧物质以诱导生物效应 ,切伦科夫光介导的光动力治疗完全可行 。且90 Y 、 89 Zr 和 68 Ga等放射性核素较 18 F可以产生更多的光子, 提供更强的切伦科夫光源 。
为了进一步探索上述途径(2)中的现象, Achilefu 教授研究了切伦科夫阀值(250 keV)以下的电离辐射照射 TiO2 的生物效应, 结果示于图5 [ 34] 。由图 5 可知:TiO2 纳米颗粒(2. 5 μg /mL) 与不产生切伦科夫辐射的 X 射线(能量小于切伦科夫阀值)在 HT1080 癌细胞凋亡过程中无协同作用, TiO2 纳米颗粒对细胞生存率没有影响 。而在 6 MeV 的电子辐射下, 加入 TiO2 会造成细胞活力的显著降低 [ 24] 。这表明切伦科夫光在生物效应中起主导作用。
5 总结与展望
将纳米技术和切伦科夫光相结合有着非常广阔的应用前景, 其在活体内进行切伦科夫成像已获成功。进入临床领域的一条可能途径是在切除肿瘤和引流前哨淋巴结时利用纳米增强切伦科夫光进行手术引导 。与 PET 成像相比 ,切伦科夫成像具有更高的表面分辨率 ,这有利于检测肿瘤边缘,并且可以使用纳米颗粒的优化对成像质量进行提升。利用切伦科夫光作为内源光实现对肿瘤的光动力治疗是对切伦科夫光的另一重要应用, 解决了经典光源穿透能力不足的难题。其实验结果无可争议,在核素与纳米材料相结合使用时 ,有着更好的肿瘤治疗效果, 但是其原理尚且存疑 ,需要进一步的解释和验证。此外, 切伦科夫辐射作为一种极弱的光, 借助特殊的设计来实现激活效果的倍增与放大是其未来能否成功用于生物体的关键 ,也是该领域亟待突破的瓶颈 。
参考文献 :
[ 1] Kobzev A P. The mechanism of Vavilov-Cher enkov r adia tion[ J] . Phys Part Nuclei , 2010 , 41(3):452- 470.
[ 2] Kobzev A P. On the radiation mechanism of a uniformly moving cha rge[ J] . Phys Part Nuclei , 2014, 45(3):628-653.
[ 3] Shaffer T M, Pratt E C, Grimm J. Utilizing the power of Cerenkov light with nanotechnology[ J] . Nat Nanotechnol , 2017, 12:106-117.
切伦科夫光 :纳米核药物诊断治疗一体化的新光源相关论文期刊你还可以了解:《《中国药物滥用防治》护理发表论》
转载请注明来自:http://www.lunwencheng.com/lunwen/yix/14720.html