摘要制备了天冬氨酸功能化石墨烯量子点-金复合物并表征了其结构和催化活性。利用天冬氨酸功能化石墨烯量子点与小尺寸纳米金结合产生的高催化活性,通过Au-S键将农药适配体连接到在纳米金表面,然后修饰到玻碳电极表面得到电化学生物传感器,构建了测定毒死蜱、多菌灵和啶虫脒的电化学方法。研究表明,农药分子与适配体的特异性结合导致了生物传感器脉冲差分伏安曲线电流的下降,峰电流响应与毒死蜱、多菌灵和啶虫脒的浓度分别在1´10-11~1´10-4mol/L,1´10-10~1´10-4mol/L和1´10-9~1´10-5mol/L之间呈良好的线性关系,检测限分别为3´10-11,3´10-10和3´10-9mol/L。该方法已成功应用于苹果中毒死蜱、多菌灵和啶虫脒的检测。
关键词:功能化石墨烯量子点;纳米金;农药残留;电化学传感器;生鲜食品
毒死蜱、多菌灵和啶虫脒是苹果成熟期最常用的农药。毒死蜱能有效地防控有害昆虫和螨虫[1]。然而,不恰当地使用毒死蜱可能造成饮用水和土壤污染,从而引发癌症[2]和生殖系统损伤[3]。多菌灵属于苯并咪唑类杀菌剂,可保护苹果免受病原菌伤害,但多菌灵可长期存在于环境和食物,引起人体内分泌紊乱,甚至患癌[4]。啶虫脒是新烟碱类广谱杀虫剂,主要用于防治半翅目、樱翅、鳞翅类等昆虫害。然而,高浓度的啶虫脒可造成人体免疫力降低[5]。建立一种可靠的方法测定苹果中毒死蜱、多菌灵和啶虫脒残留量具有重要现实意义。
测定痕量农药残留的分析方法主要是高效液相色谱法(HPLC)[6]、气相色谱-质谱联用法(GC-MS)[7]、紫外-可见光度法[8]、荧光光谱法[9]、毛细管电泳法[10]和电化学法[11]。HPLC和GC-MS是实验室测定农药残留最常用的分析方法,但需要昂贵的仪器和熟练的操作人员,难以应用于农残的快速检测和现场分析[12]。光度法操作简单,重现性好,但灵敏度远低于GC-MS[1]。荧光法具有高的灵敏度和选择性,但检测信号易受温度等环境因素影响,给实际应用带来诸多不便[13]。毛细管电泳法具有极好的分离能力,能方便地实现多种农药的同时检测,但食品基质干扰严重,需要严格的样品预处理后才能用于毛细管电泳分析[12]。近年,电化学生物传感器在生鲜食品中农药残留测定中的应用受到更多关注[11,14]。
采用天冬氨酸功能化石墨烯量子点与氯金酸反应制备了天冬氨酸功能化石墨烯量子点-金复合物(AspGQD-Au)。天冬氨酸功能化石墨烯量子点既是还原剂又是稳定剂,最终修饰到纳米金的表面。天冬氨酸功能化石墨烯量子点与纳米金的结合进一步提高了电催化活性。将巯基修饰的适配体通过Au-S连接到纳米金表面然后固定于玻碳电极表面制备出电化学传感器。Asp-GQD-Au高催化活性导致了对毒死蜱、多菌灵和啶虫脒产生的高灵敏电化学响应。方法已成功应用于苹果中毒死蜱、多菌灵和啶虫脒的电化学检测。
1实验部分
1.1仪器与试剂
HITACHIS4800扫描电子显微镜(SEM)(日本HITACHI公司),JEM-2100(HR)透射电子显微镜(美国FEI公司),MuLtimode8原子力显微镜(德国布鲁克公司),Nicolet6700全反射傅立叶红外光谱仪(美国赛默飞世尔公司),CHI660D电化学分析仪(上海辰华公司)。
毒死蜱、多菌灵和啶虫脒购自上海农药研究所;柠檬酸(CA)、天冬氨酸(Asp)、KCl、NaCl、Na2HPO4·12H2O、KH2PO4·2H2O、K3(FeCN)6、亚铁氰化钾(K4(FeCN)6·3H2O)、乙二胺四乙酸二钠(EDTA)和壳聚糖(CS)购自国药集团化学试剂公司;氯金酸(HAuCl4·3H2O)、三羟甲基氨基甲烷(Tris)、6-巯基-1-己醇(MCH)、三(2-羧乙基)膦盐酸盐(TCEP)购自上海麦克林生化科技公司;3种农药适配体由上海生工生物技术公司合成与纯化(毒死蜱的适配体:5′-SH-(CH2)6-CCTGCCACGCTCCGCAAGCTTAGGGTTACGCCTGCAGCGATTCTTGATCGCGCTGCTGGTAATCCTTCTTTAAGCTTGGCACCCGCATCT-3′;多菌灵的适配体:5′-SH-(CH2)6-GGGCACACAACAACCGATGGTCCAGCCACCCGAATGACCAGCCCACCCGCCACCCCGCG-3′;啶虫脒的适配体为5′-SH-(CH2)6-TGTAATTTGTCTGCAGCGGTTCTTGATCGCTGACACCATATTATGAAGA-3′。0.1mol/L磷酸盐缓冲液(PBS)的配制:5.44gKH2PO4·2H2O、57.30gNa2HPO4·12H2O、18gNaCl和3.87gKCl溶于2L超纯水;将适配体溶解于TE缓冲液中。TE缓冲溶液含10mmol/LTris,1mmol/LEDTA和1mmol/LCaCl2;实验中所有试剂都是AR,用水都来自于Milli-Q净水系统制备的超纯水。
1.2Asp-GQD-Au制备
将1.27mL10mmol/LHAuCl4加热到95℃并保温5min,然后在搅拌下加入10mL5mg/mLAsp-GQD溶液,直到溶液由黄色转变为酒红色,继续加热8min,冷却至室温,在8000r/min下离心10min。将收集的Asp-GQD-Au重新分散在1mL水中,置于4℃的冰箱中备用[15]。
1.3适配体传感器的制备
采用0.05mmAl2O3粉末打磨GCE(直径为2mm),然后用乙醇和去离子水依次超声清洗电极5min,空气中自然晾干备用。将Asp-GQD-Au与CS(1%)等体积混合,此混合溶液5mL滴于电极表面,室温下自然晾干得到Asp-GQD-Au/GCE。将毒死蜱适配体与0.5mmol/LTCEP等体积混合后,室温还原30min,然后滴5mL5mmol/L毒死蜱适配体于GCE表面,4℃下孵育12h,二次水洗涤电极表面除去物理吸附的适配体,得到Apt/Asp-GQD-Au/GCE。滴加5mL1mmol/LMCH到电极表面以封闭的活性位点,二次水洗涤电极,得到MCH/Apt/Asp-GQD-Au/GCE,置于4℃冰箱中备用。以上方法还用于多菌灵和啶虫脒生物传感器的制备,仅用多菌灵适配体或啶虫脒适配体替代毒死蜱适配体即可。
1.4电化学测试
所有的电化学测试采用一个经典的三电极测试系统,修饰后的GCE作为工作电极,Ag/AgCl标准电极作为参比电极,铂丝作为对电极。所有的电化学测试都在室温下进行,电解液为含有1mmol/LK2[Fe(CN)6]的PBS缓冲溶液(0.1mol/L,pH7.4)。循环伏安测试(CV)的电压扫描范围为-0.1~0.7V,扫描速度100mV/s。电化学交流阻抗测试(EIS)的频率范围为105~0.1Hz,电位振幅为±5mV。差分脉冲伏安测试(DPV)电位振幅为50mV,脉冲宽度为50ms,初始电压-0.1V。对于毒死蜱的测定,吸取5mL农药标准溶液(或样品溶液)滴于电极表面,室温孵育30min(多菌灵和啶虫脒的孵育时间分别是40和60min)采用二次水洗涤电极表面去掉未结合的农药分子,然后将此电极浸入到上述电解液中测定DPV信号。
2结果与讨论
2.1Asp-GQD-Au合成与结构表征
Asp-GQD-Au合成采用将Asp-GQD与HAuCl4混合一步反应得到Asp-GQD-Au。当HAuCl4溶液加入到Asp-GQD溶液后,体系迅速由浅黄色转变为深红色,证明已形成Asp-GQD-Au。Asp-GQD作为还原性,可将Au3+还原为无色的Au+,最终形成酒红色的金纳米粒子。Asp-GQD作为稳定剂,可与Au+共价键合而最终固定于金纳米粒子的表面。一方面,Asp-GQD固定在金核表面形成一个亲水性“壳”层,使金纳米粒子具有良好的水溶性。另一方面,Asp-GQD与Au+的共价健合显著降低了形成Au0的速率,这种缓释作用可有效地调控金纳米粒子的尺寸,从而形成尺寸较小的金纳米粒子。最为重要的是,利用石墨烯量子点与金纳米粒子的杂化实现电催化活性改善。
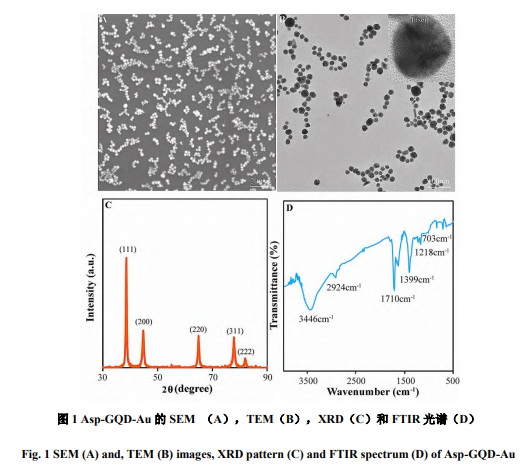
采用SEM,TEM,XRD和FTIR对所制备的Asp-GQD-Au进行了结构表征。从图1可知,金纳米粒子呈现规则的球形,具有较好的尺寸和形貌均一性,平均粒径的15±2nm。从放大的TEM图可以看出,金纳米粒子并非圆滑的球面,存在许多棱角,这些棱角有利于提高催化活性。另外,纳米金表面有许多相对暗的圆点,这可能是Asp-GQD。XRD图上有5个尖锐的衍射峰,分别对应于金晶体的(111),(200),(220),(311)和(222)晶面,这证明形成了金纳米晶体。FTIR光谱上有一系列红外吸收峰和吸收带。3300~3600cm-1的吸收带来源于Asp-GQD中O-H键和N-H键伸缩振动。2924cm-1处的吸收峰是由饱和CH键的伸缩振动造成的。1710cm-1来自C=O伸缩振动。1380cm-1来自C-O拉伸振动。红外分析结果证实,Asp-GQD-Au表面存在Asp-GQD。
2.2催化活性
为了评估Asp-GQD-Au的催化活性,在金纳米粒子(AuNPs)和Asp-GQD-Au存在下催化反应体系的紫外-可见吸收光谱被测定。从图2可以看出,在AuNPs和Asp-GQD-Au存在下反应体系的颜色迅速由无色转化为蓝色,说明它们对TMB的氧化具有催化作用。因此,AuNPs和Asp-GQD-Au都可作为类氧化酶的人工酶。然而,Asp-GQD-Au存在的氧化反应体系有一个更高的吸光度,证明Asp-GQD-Au的催化活性明显高于AuNPs。因为Asp-GQD是一种N型半导体,而Au是一种导体,它们的结合将在界面上形成Schottky异质结。异质结的形成减少了它们之间的能垒,有利于电子/能量转移,从而改善了人工酶的催化活性。
2.3适配体传感器的构建及电化学行为
为构建毒死蜱适配体传感器,首先滴加Asp-GQD-Au和CS的混合溶液于GCE表面,然后利用Au-S键将毒死蜱适配体(Aptamer)修饰到纳米金表面,干燥后用MCH封闭剩余的活性位点。将电极放入含有毒死蜱(或其他农药)的溶液中孵育,毒死蜱与适配体在电极表面结合而形成稳定的复合物,导致电极电化学性质发生改变而产生灵敏的电化学响应。上述方法还可用于其他适配体传感器的构建,仅需采用相应的适配体替代毒死蜱适配体即可(图3所示)。
相关知识推荐:什么时候发表论文在有效期内
为了证实适配体传感器测定农药的可行性,各种修饰电极在含有1.0mmol/LK3Fe(CN)6的PBS(pH7.4)中的CV和EIS行为被研究。从图4可知,所有电极的CV曲线都有一对氧化还原峰,这是因为K3Fe(CN)6在电极表面的氧化还原反应所致。相对于GCE裸电极,修饰Asp-GQD-Au后电极的CV电流明显增大。由于Asp-GQD-Au有良好的导电性,且对K3Fe(CN)6的氧化还原具有显著的催化作用,加快了电极反应,导致一个更高的CV峰电流和更小的电荷转移电阻(Rct)。然而,连接适配体后CV峰电流下降而Rct增大。这是因为形成Au-S后修饰层的导电性变差,造成电极反应变慢,因此导致了CV电流的下降和Rct增大。与适配体的修饰行为相似,采用MCH封闭活性位点后,CV明显变小而Rct迅速增大。当电极在置入到含有毒死蜱的溶液孵育后,CV电流明显变小,而Ret大幅度增加。由于电极表面的适配体与毒死蜱之间有高的亲合力,它们相互作用将形成稳定的复合物,这些复合物将堵塞电极与电解质之间的电子与离子传输通道。此外,复合物的形成还使电极修饰层的导电性变差。以上2方面的原因造成了CV电流的下降和Ret值的增大。以上研究结果表明,所制备的适配体传感器对毒死蜱(或其他农药)有灵敏的电化学响应。
2.4对农药的电化学响应
为考察传感器对农药分子的电化学响应,修饰电极在含有1´10-9mol/L毒死蜱的电解液中孵育前后的CV和DPV曲线被测定。图5表明,电极在含有毒死蜱的电解液中孵育后CV和DPV峰电流都减小了。由于适配体与毒死蜱之间有强的亲和力,孵育过程中适配体将与毒死蜱结合形成稳定的复合物,所形成的复合物将部分堵塞电极与电解质之间的电子传输通道,导致CV和DPV峰电流减小。由于DPV测试有更强的峰电流响应,DPV被选择用于电化学测定毒死蜱、多菌灵和啶虫脒。
2.5测定条件优化
为了优化测定条件,考察了适配体浓度和电极在含有毒死蜱的电解液中孵育时间对DPV峰电流(DIp)的影响。结果表明,当适配体浓度小于5mmol/LDIp随适配体浓度的增加而增大。当适配体浓度为5mmol/L时,DIp达到最大。然后,继续增加适配体浓度DIp将不再有明显的变化,表明适配体结合位点已达到饱和。为了得到高的灵敏度,5mol/L毒死蜱适配体被选择用于电化学测定毒死蜱。当孵育时间少于30min,DIp随孵育时间的增加而增大。当孵育时间为30min时,DIp达到最大。然后,继续延长孵育时间DIp不再增加,说明适配体与毒死蜱之间的结合已经达到平衡。为节省分析时间,30min孵育时间被选择电化学测定毒死蜱。按照以上相似的实验方法对电化学测定多菌灵和啶虫脒的条件进行了优化。优化后的多菌灵测定条件是:6mmol/L适配体和40min孵育时间。优化后的啶虫脒测定条件是:8mmol/L适配体和60min孵育时间。
2.6适配体传感器的分析性能
在最佳测定条件下,修饰电极在不同浓度的毒死蜱溶液中孵育后的DPV曲线列于图6,随着毒死蜱浓度增大DPV电流逐步减小。这是因为随着毒死蜱浓度的增加电极表面形成的适配体-毒死蜱复合物越多,这将堵塞更多的电子转输通道,使DPV电流减小。结果表明,当毒死蜱浓度在1´10-11~1´10-4mol/L范围变化时,Ip与毒死蜱浓度对数呈现良好的线性关系,其线性方程式为:Ip(mA)=-0.9538LOG(c,mol/L)+25.824,R2=0.994。方法检出限(S/N=3)为3´10-11mol/L。按照以上相同的实验方法还研究了多菌灵和啶虫脒浓度对修饰电极DPV峰电流响应的影响。结果表明,测定多菌灵的线性范围为1´10-10~1´10-4mol/L,检出限为3´10-10mol/L。测定啶虫脒的线性范围为1´10-9~1´10-5mol/L,检出限为3´10-9mol/L。将不同电化学传感器测定毒死蜱、多菌灵和啶虫脒的分析参数列于表1,可以看出,建议的方法具有较高的灵敏度和更宽的线性范围。
除了毒死蜱、多菌灵及啶虫脒,苹果中常见的农药有甲基对硫磷、氯氟氰菊酯、二嗪农、异戊腈。这些组分有可能对分析产生干扰。因此,将1´10-4mol/L有可能存在干扰的物质分别滴在电极上孵育后,用于DPV的测试。结果表明,峰电流变化均小于5%,证明方法具有优良的选择性。用相同的方法制备6根适配体传感器,并分别用于测定1´10-9mol/L毒死蜱的电化学响应。Ip的相对标准偏差为3%。证明传感器具有较好的批量生产重现性。将修饰的电极置于4℃冰箱中储存,每2天测试一次。结果显示,1个月后Ip仍然是初始值的95%,说明电化学适配体传感器具有长期稳定性。
2.7苹果中毒死蜱、多菌灵和啶虫脒的测定
所制备的适配体传感器用于实际苹果样品中的毒死蜱、多菌灵和啶虫脒的测定,测定结果列于表2。为测定方法的加标回收率,向苹果提取液中加入已知浓度的农药标准溶液,然后测定它们的农药浓度并计算回收率[27]。从表2可以看出,加标回收率为95.0%~114.0%之间,说明方法具有较高的准确性。——论文作者:王金,李在均
转载请注明来自:http://www.lunwencheng.com/lunwen/dzi/20829.html