摘 要 肺是人体呼吸系统的重要组成部分,气道上皮是肺与外界接触的第一道屏障,参与抵御外来的颗粒物、病原体等,可将异物以痰的形式排出体外,对维护呼吸道正常功能起到至关重要的作用。常用的体外细胞培养模型和哺乳动物模型尚不能完全模拟人体肺-气道微环境,在人体细胞与病原体相互作用研究和药物研发应用方面具有一定的局限性。该研究设计制作了一种基于微流控技术的双通道肺器官芯片,通过改进制备工艺使其能够满足高倍镜极短工作距离的要求,用于高分辨率成像;实现了模拟人体肺-气道微环境的气液界面气道上皮培养,并且能够实时观察细胞与细菌的共培养过程,为体外研究气道上皮和病原微生物的相互作用提供一个有力平台。
关键词 肺芯片;微流控;高分辨率成像;铜绿假单胞菌;肺炎模型
1引言
肺是人体与外界空气进行气体交换的重要器官,其基础结构由支气管反复分支形成的支气管树构成。支气管上皮作为肺的保护屏障,包含多种细胞类型,其中杯状细胞能够分泌黏蛋白,在上皮表面形成黏液性屏障,黏附流通进入支气管的空气所包含的异物颗粒,同时溶解有毒气体。另一方面,支气管上皮的纤毛能够通过节律性的摆动将黏液及其上附着的粉尘、细菌等推向咽部,以痰的形式排出体外[1-2]。
由于人体呼吸道直接与外部环境相通,肺易遭受大气污染物的刺激和破坏[3],同时也容易受到病原微生物的侵袭[4-5]。其中,细菌和病毒所引起的肺部疾病最为常见,如肺炎球菌肺炎、铜绿假单胞菌肺炎等[6]。目前耐药性细菌成为肺炎治疗急需解决的关键问题之一[7],同时,有些病原体的致病机制也尚未明确,这给临床上肺部疾病的治疗带来了较大的挑战。在对致病菌的机制研究中,细菌的迁移、黏附和侵袭等运动机制的研究可以帮助理解复杂疾病的致病机理,但是由于细菌体积较小,故其运动机制的研究往往依赖于高分辨成像技术。其中,基于高分辨成像技术,能够更加直观且实时观测到细菌在人体细胞上发生的生理变化规律。对于肺部疾病致病机制和临床前药物开发的相关研究,目前常用的仍是体外细胞培养模型和哺乳动物模型[8]。但常规的二维(2D)细胞培养难以反映体内复杂的组织器官功能特点,也无法反映人体组织器官对外界刺激产生的真实响应[9]。哺乳动物模型可以提供一定的体内信息,但动物实验周期长、成本高,与人体存在较大的种属差异,因此对人体实际反应的预测能力较差[10]。不仅如此,在体外细胞培养模型和哺乳动物模型中几乎无法对作用于其中的单个细菌进行分析观察和实时成像,同时对于细菌的观察也严重受限于目前常用的高分辨成像仪器的工作距离。人体器官芯片是近年来兴起的多学科交叉新技术,将微流控技术和细胞生物学进行结合,能够在微流控芯片上模拟人体器官的结构和微环境[11-13],并已用于人类疾病发生和发展过程研究[14-15]、临床药物研发[16-17]以及体外生化诊断检测[18]等。
在众多人体器官芯片中,肺芯片是最早被提出和开发的器官芯片之一[19]。目前,肺芯片装置多具有双层通道,由聚二甲基硅氧烷(Polydimethylsiloxane,PDMS)制成的微孔膜隔开,通过在膜的上表面培养人体肺上皮细胞并覆盖空气来模拟气管,而在同一膜的对侧培养人血管内皮细胞并覆盖流动介质来模拟血管,重建肺泡-毛细血管界面,模拟肺部微环境[20-21],可研究肺芯片上细胞-细胞[22]、细胞-基质[23]、细胞病原体[24-26]等相互作用。在此基础上,一些肺部疾病模型也得以在肺芯片上构建,如慢性阻塞性肺疾病(ChronicObstructivePulmonaryDisease,COPD)[27-28]、哮喘[29]、肺炎[30]、肺损伤[31]、肺纤维化[32]、肺癌[33]等,这在肺部相关疾病的研究和实现个性化诊断及治疗上具有巨大的潜力。目前直观地反映和分析微流控肺芯片上人体细胞与细胞、细胞与病原体之间的相互作用需要借助高倍镜下的显微成像技术,而现有的肺芯片尺寸设计不能满足高倍镜低工作距离的要求,因此无法在高倍显微镜下对细菌清晰成像,限制了肺芯片上对细胞与细菌之间相互作用的研究。
本研究拟对现有的肺芯片制作工艺进行改良,构建一种可用于高分辨率成像的肺器官芯片,通过采用人支气管上皮样细胞(16HBE细胞)重现肺部黏液屏障来模拟肺部微环境。同时,将16HBE细胞与铜绿假单胞菌进行共培养,构建一个简易的铜绿假单胞菌感染模型,直观观察细菌在细胞上的运动与定位,为人体肺组织与细菌的相互作用研究提供一个简便而有效的体外模型。
2材料和方法
2.1材料
聚二甲基硅氧烷(PDMS)单体与引发剂均购于美国DowCorning公司;光刻胶SU-82100和SU-83050均购于美国Microchem公司;三氯(1H,1H,2H,2H-全氟辛基)硅烷购于美国SigmaAldrich公司;空白菲林片购于深圳清溢光电股份有限公司;16HBE细胞购于国家实验细胞资源共享平台;MEM(MinimumEssentialMedium)培养基、胎牛血清和鼠尾I型胶原蛋白均购于美国Gibco公司;青链霉素混合液、0.25%胰蛋白酶、磷酸盐缓冲液(PhosphateBufferSaline,PBS)均购于美国Hyclone公司;ZO-1抗体购于美国ThermoFisherScientific公司;DAPI染色液购于江苏凯基生物技术股份有限公司;阿利新蓝染色液购于北京索莱宝科技有限公司;等离子清洗仪购于美国HarrickPlasma公司;微量注射泵购于美国HarvardApparatus公司;激光共聚焦显微镜为日本尼康公司生产制造;CO2细胞培养箱购于美国ThermoFisherScientific公司。
2.2用于高分辨率成像的肺器官芯片制作
(1)SU-8模板设计与制作
上通道和下通道SU-8模板制作:首先,将硅片放进等离子清洗仪中档清洗10min。然后,利用匀胶机将光刻胶SU-82100铺满制作上通道的硅片,用SU-83050铺满制作下通道的硅片。其中,上通道的匀胶转速为1300r/min,下通道的匀胶转速为1875r/min,二者匀胶时间均为30s。铺胶完成后,将硅片置于热板上95℃前烘1h。待硅片自然冷却至室温后,用事先打印好的芯片掩膜覆盖于玻璃片SU-8胶层上,置于紫外光刻机下曝光。曝光后立即将掩膜去掉,将硅片置于热板上95℃后烘20min。待硅片自然冷却至室温,用显影液进行显影,溶去未经曝光的SU-8光刻胶,显影后用异丙醇清洗硅片模板,并用压缩空气将其吹干。最后,将模板放入烘箱内180℃坚膜30min。
微柱阵列模板制作:与上、下通道匀胶过程相似,先使用SU-83035光刻胶,匀胶速度为2500~2750r/min,匀胶时间30s,95℃前烘20min;随后利用旋涂仪进行去边操作,再前烘10min,真空曝光,95℃后烘5min;最后,进行显影和坚膜。
(2)上通道PDMS制作
将PDMS单体与引发剂以质量比10∶1混合均匀,倒入上通道SU-8的模板上,真空抽气除气泡,在80℃下烘30min,固化后将PDMS从模板上剥离。
(3)下通道PDMS及PDMS多孔膜制作
下通道及微柱阵列模板的硅烷化处理:首先,分别将装有下通道模板和微柱阵列模板的干净培养皿放入烘箱,80℃干燥30min;然后,用等离子清洗仪处理干燥后的模板,低档处理10min后将其放入真空干燥器内,将20µL三氯(1H,1H,2H,2H-全氟辛基)硅烷滴加到一片提前放置在真空干燥器内的干净载玻片上,隔膜泵抽真空10min;最后,关闭隔膜泵,关紧干燥器阀门,静置12h以上。
将PDMS单体和引发剂以质量比10∶1混合均匀,放入玻璃罐内抽真空除去气泡后浇筑在下通道模板和多孔膜模板表面。随后,将微柱阵列模板转移到烘箱内的水平台上,于模板上面放一片经等离子体高档处理5min的菲林片,并在其上放一块厚1cm的PDMS块。紧接着在PDMS压块上表面放置一块厚玻璃,且在玻璃上表面压上1.5kg的砝码,手动调节维持砝码、PDMS压块及微柱阵列区域保持同一中心轴,待PDMS压块不再滑动时即可。同时,在下通道模板上覆盖相同处理的菲林片,再于其上放置一块覆盖通道结构的磁铁,下方放置另一块磁铁,使两块磁铁平稳地吸附起来,接着将整个装置放置于烘箱内。最后,将下通道PDMS及多孔膜结构置于60℃烘箱内固化12h。
待固化完成后,移去砝码、磁铁、厚PDMS块及玻璃,将菲林片与硅片模板分离,此时下通道PDMS及PDMS多孔膜均黏附在菲林片上。
(4)封接
首先,将上通道PDMS与附在菲林片上的PDMS多孔膜进行等离子体封接,于80℃烘箱内烘10min后,用手术刀将封接体从菲林片上切割后揭下,接着用打孔器在封接体上层通道PDMS的两个进样端及两个废液端打孔;然后,将厚度为170µm的盖玻片与附有下通道PDMS的菲林片进行等离子体封接并放入80℃烘箱内烘10min后,使用手术刀去除其上附着的菲林片;最后,将两次封接的产物进行等离子体封接,放入80℃烘箱内烘10min。
2.3细胞培养
16HBE细胞采用含10%胎牛血清、1%青链霉素混合液的MEM完全培养基培养,置于37℃、5%CO2的培养箱内进行培养。
肺芯片中的细胞培养:芯片在使用前进行紫外消毒2h。用MEM基础培养基将3.55mg/mL的鼠尾I型胶原蛋白稀释为30µg/mL的胶原溶液,将配制好的胶原溶液注入到芯片的通道内,使其充满通道且无气泡产生,随后放入37℃培养箱内2h进行表面胶原修饰。紧接着,将软管与芯片连接,设置微量注射泵流速为30µL/h,过夜灌注完全培养基。用0.25%胰蛋白酶将16HBE消化下来,再用MEM完全培养基将其重悬为单细胞悬液,调整细胞密度为107cell/mL并接种于芯片通道内。待16HBE细胞在通道内沉降2h后,设置微量注射泵流速为30µL/h培养24~48h。进行气-液界面(Air-LiquidInterface,ALI)培养时,将上通道灌注的MEM完全培养基去除,更换为湿润的空气,以30µL/h流速培养24~48h,此时肺芯片中气-液界面形成。
2.4细菌培养
实验所用的菌株由铜绿假单胞菌(PAO1,ATCC15692)改造而来,导入质粒J23102-GFPPUCP22可得到表达绿色荧光的菌株。
将冻存的菌种从-80℃冰箱取出置于冰上,于超净工作台内使用无菌枪头蘸取菌种,并在带有庆大霉素抗性的苛养厌氧菌琼脂(FastidiousAnaerobeAgar,FAA)平板上划线,然后将其置于37℃培养箱内过夜培养。第二日取出平板观察菌落生长情况,挑取平板上生长旺盛且单独生长的单菌落,接种于新鲜无菌的庆大霉素抗性的苛养厌氧菌肉汤(FastidiousAnaerobeBroth,FAB)培养基内,200r/min摇菌培养(培养温度为37℃)。
肺芯片中的细菌培养:在加入细菌前将已培养好16HBE细胞的肺芯片上、下通道使用的培养基更换为不带抗生素的MEM完全培养基。将处于对数期的细菌菌液在室温下以5000r/min离心10min。去除上清后,使用MEM完全培养基将细菌重悬到光密度为0.4。然后,使用一次性1mL无菌注射器吸取细菌悬液,由上通道出口处注入芯片内。待细菌沉降5min后,设置注射泵流速为30µL/h培养。在细菌与细胞共培养过程中,将芯片置于激光共聚焦显微镜下观察细菌的定殖情况。
2.5细胞表征
(1)黏液:将肺芯片从培养箱内取出并拆除外部管道,用PBS冲洗通道3次,再用4%多聚甲醛固定细胞15min。接着用PBS清洗通道3次,向通道内注入阿利新蓝酸化液A,室温孵育3min后,再向通道内注入阿利新蓝染色液B,室温避光孵育30min。最后用PBS冲洗通道内部残留的染液,将芯片置于倒置相差显微镜下观察。
(2)紧密连接:将肺芯片从培养箱内取出并拆除外部管道,先用PBS冲洗通道3次,接着向通道内注入4%多聚甲醛固定15min。然后,用PBS冲洗通道以除去多聚甲醛,加入0.2%TritonX-100透化10min。再次使用PBS冲洗3次,注入5%BSA(BovineSerumAlbumin)封闭1h。封闭后用PBS冲洗通道,加入1∶100稀释的ZO-1抗体4℃孵育过夜。次日复温后,PBS冲洗3次洗去抗体,加入DAPI染色液孵育5min,用PBS洗去染色液,避光于激光共聚焦显微镜下观察。
3实验结果
3.1用于高分辨率成像的肺器官芯片性能评价
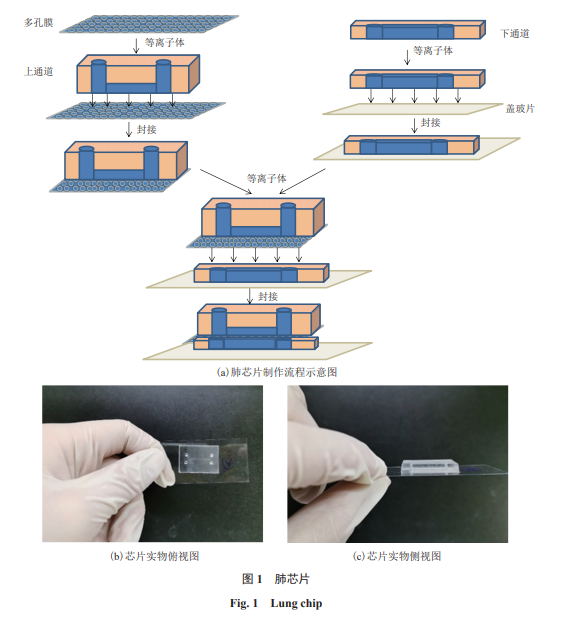
为构建肺器官芯片,本文采用SU-8光刻技术制作了由PDMS组成的微流体装置。PDMS是一种具有较好理化性质和生物兼容性的有机聚合物材料,其材质偏软且无毒,适合细胞的培养。本文中的微流控肺芯片结构主要由上通道、多孔膜、下通道和盖玻片4个部分组成。其中,芯片上微通道长1cm、宽1mm,上层微通道高125µm,类似于人类支气管的半径;下层微通道高55µm,上、下通道之间含有微柱阵列的多孔膜厚度为32.5µm,细胞培养基可以通过灌注下通道给多孔膜上的细胞提供营养;双通道的结构设计使芯片能够形成气-液界面,可模拟人体肺部气道微环境。肺芯片制作流程如图1(a)所示。
相关知识推荐:论文发表审稿通过意味着什么
目前大多数研究中使用的双通道肺芯片在显微镜下观察时,由于下通道结构太厚,远远大于高倍物镜的低工作距离,进而无法在高倍镜下观察细微的生物现象,如细菌在细胞表面的黏附、迁移等。为解决肺芯片中细菌在高倍镜下的成像问题,本文对以往的肺芯片制作工艺进行了改进——将下通道高度降低为55µm,通道底部不再由PDMS封接,而是由厚度为170µm的盖玻片封接。这一设计工艺制作出来的肺芯片符合60倍油镜下成像的工作距离要求。肺芯片整体实物图如图1(b~c)所示。
3.2基于肺器官芯片的气道上皮模型构建
为了模拟人体肺支气管上皮,本文采用Ⅰ型鼠尾胶原对芯片内部进行修饰,在芯片中注入源于正常人支气管上皮组织的人支气管上皮细胞——16HBE细胞进行液-液界面培养。为了促进肺气道上皮细胞的分化、及更好地模拟肺部气道的微环境,当16HBE细胞生长铺满整个多孔膜并融合为一个组织界面时,将上层培养基去除,引入湿润的空气以形成气-液界面。倒置相差显微镜观察结果显示,16HBE能够在肺芯片上正常生长,并且当生长环境切换为气-液界面时,16HBE细胞未出现明显的细胞脱落,保持与液液界面细胞培养时相同细胞形态并且能够持续增殖。16HBE细胞在液-液界面培养24h后的生长状态如图2(a)所示,在气-液界面培养24h、48h后的生长状态如图2(b、c)所示。
3.3支气管上皮功能表征
肺部黏液是肺组织的重要保护屏障。本文采用阿利新蓝染色法鉴定肺芯片上黏液的产生。倒置相差显微镜下观察发现,肺芯片上气-液界面培养切换前后细胞黏液的分泌量无明显差异。如图2(d~f)所示。紧密连接是构建细胞骨架的重要结构,而紧密连接蛋白ZO-1是其重要组成蛋白之一。ZO-1不仅能够调节上皮屏障功能,还能维持上皮细胞极性。肺支气管上皮细胞通过含有ZO-1的紧密连接而连接在一起。为了验证肺芯片的生理功能,本研究在肺芯片上培养肺支气管上皮细胞16HBE,然后对芯片上的细胞进行免疫荧光染色。在激光共聚焦显微镜下观察发现,被红色染料标记的ZO-1沿细胞顶端表面的外缘均匀分布且边缘清晰,被蓝色的DAPI染料标记的细胞核清晰可见,并且转换为气-液界面培养的肺芯片与液-液界面培养条件下16HBE细胞紧密连接蛋白的表达未见明显差异,如图2(g~i)所示。
肺芯片上16HBE细胞紧密连接蛋白ZO-1的表达和黏液的分泌表明,本研究中构建的肺芯片具有肺支气管上皮细胞的功能,能够用于后续实验研究中。
3.4肺芯片上的细胞与细菌共培养及高分辨率成像
铜绿假单胞菌肺炎是近年来医院内感染最常见的肺部炎症之一。为了更直观地观察铜绿假单胞菌与人体细胞间的相互作用,本研究将肺芯片改造为符合高成像分辨显微镜60倍油镜下成像工作距离要求的器官芯片。具体地,将带有绿色荧光质粒的铜绿假单胞菌接种在构建好的肺上皮模型上,于60倍油镜下实时观察铜绿假单胞菌在16HBE细胞上的定殖、迁移和黏附情况。细菌接种5min后,连通注射泵去除未沉降的细菌。如图3所示,经过20h的共培养后,细菌仍黏附在细胞表面,与16h相比,细菌绿色荧光的表达显著增多,能够明显观察到细菌增殖并且主要定殖在细胞与细胞之间的区域。即改造设计后的肺芯片能够清晰地观察到细菌在肺支气管上皮细胞上的定殖、迁移和黏附等。
为了进一步观察肺芯片上细菌与人体细胞的相互作用,本文在铜绿假单胞菌与16HBE细胞共培养14h后对肺支气管上皮细胞的紧密连接ZO-1进行了表征。如图4所示,在细菌侵染后,芯片内的细胞数量明显减少,细胞的紧密连接蛋白ZO-1的表达明显降低。——论文作者:辛 颖1# 徐宝琪2# 王军杰2# 张荣荣1# 温 慧1 王金娟1梁 帆1 金 帆1 梁 卓3 黄建东1,4* 黄术强1*
转载请注明来自:http://www.lunwencheng.com/lunwen/dzi/20888.html