摘要:生物絮团进行50d的启动培养,通过300目筛网筛出3组不同粒径分组,分别为不分级粒径组、<50μm粒径组和>50μm粒径组。在3组反应器中分别加入10mg/L的总氨氮,以碳氮比为15的标准在反应器中加入葡萄糖,探究水体中氨氮的去除效果。试验结果显示,不同粒径的絮体组对总氨氮的去除速度无显著差异(P>0.05),硝化效率差异不显著。利用高通量测序技术对生物絮体的细菌群落结构进行分析。检测结果表明,不同粒径絮体组在门、纲、属水平上的微生物群落组成基本相似,生物絮团培养过程中主要微生物类群隶属于6个纲:放线菌纲、α-变形菌纲、β-变形菌纲、γ-变形菌纲、芽孢杆菌纲、鞘脂杆菌纲。在属水平上,红球菌属、微杆菌属、噬氢菌属、芽孢杆菌属为优势菌属,其余还有副球菌属、假单孢菌属、水单胞菌属、分支杆菌属、丝状菌属等多个菌属和一些未知菌属。<50µm粒径组厚壁菌门(芽孢杆菌属)显著高于其余两组(P<0.05),粒径对厚壁菌门(芽孢杆菌属)的丰度造成显著性影响。添加碳源可以提高微生物群落的多样性和稳定性。
关键词:生物絮团—水产养殖系统;絮体粒径;硝化作用;微生物群落;高通量测序
集约化生产方式使水产养殖的放养密度和高蛋白饲料的投放量明显增加。氨氮是蛋白质代谢的最终产物之一。据估算,氨氮产生量约为投喂饲料蛋白质的9.2%[1]。氨氮的积累会直接抑制养殖动物的生长,降低其存活率[2]。水体中氮素的去除主要是通过硝化作用和反硝化作用[3-5]。在生物絮团—水产养殖系统中,硝化现象普遍发生[6]。水体中的硝化作用受一系列因素影响,如环境因子、生态因素、生物因子等[7]。硝化过程通常发生在有机物浓度较低的环境中[8],硝化效率在一定范围内随着碳氮比的增加而降低[9]。生物絮团主要由浮游生物、细菌、原生动物和颗粒有机体等组成[10];絮体形状不规则,可压缩性强,具有高度渗透性(超过99%的穿透力),且随液体渗透而不固定[3,11-17]。絮团的粒径变化区间大,从几微米到几百微米甚至数千微米,高度多孔,比表面积为20~100cm²/mL。通常认为生物絮团—水产养殖系统中稳定的生物絮团大小为50~1000µm[12]。这些物理和生物特性,使生物絮凝技术反应器具有吸附、絮凝固体颗粒物并对其进一步利用的潜能。在生物絮团—水产养殖系统中,生物絮团的粒径可能与培养对象对絮团的摄取能力、消化率以及营养价值有关[3]。
随着对生物絮团的深入研究,已有生物絮团影响因素碳源、碳氮比、水体混合强度、水力停留时间、pH、溶解氧、温度、碱度、盐度和反应器结构及活性污泥粒径等方面的研究,但对生物絮团絮体粒径的相关研究还较少。笔者从絮体本身出发,以50µm粒径滤膜截留絮团附着细菌,未被50µm粒径滤膜截留的非附着细菌,再采用0.22µm粒径滤膜截留[4,18],运用高通量测序技术,揭示絮体内部微生物多样性,为进一步研究生物絮团各反应阶段的微生物组成比例变化提供数据基础,对探究生物絮团硝化作用具有重要的指导意义。
1材料与方法
1.1试验装置及材料
试验于上海海洋大学循环水养殖工程与技术实验室进行。生物絮团反应器为9个7L有机玻璃圆锥体反应器,全高30cm,锥高4cm,内径18.5cm,外径20cm,有效容积5L。选用的气泵为功率为138W、曝气量为100L/min,通过分接器和软管在每个反应器中设置2个曝气头(直径3cm、高3.5cm的石英砂聚合气石),为水体提供氧气和搅拌。
1.2试验设计
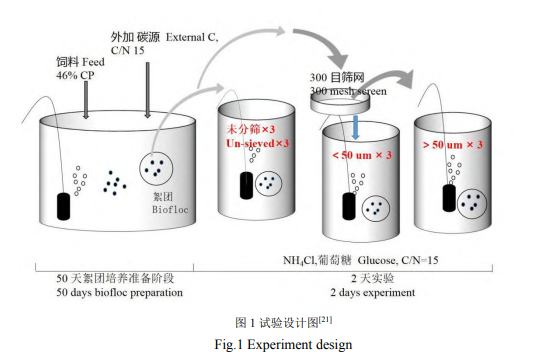
试验开始前50d,在3个150L养殖水桶培养稳定良好的絮体(图1)[19]。各水桶中投入150g磨碎后的宝石鲈鱼饲料,初始总悬浮固体物质量浓度(TSS)1000mg/L。通过添加碳酸氢钠调控碱度保持在150mg/L(以碳酸钙计,下同)。试验期间除了补充因蒸发而损失的水分,不换水。一台罗茨鼓风机供氧(型号HG-750,浙江森森集团股份有限公司),采用间歇式曝气方式(曝气8h停止16h)将系统进行闷曝72h后开始添加碳源[20]。试验开始时一次性投入足够的葡萄糖,使系统中碳氮比为15。
待水体中氨氮、亚硝态氮降至最低值,视为系统稳定构建,取3个空桶标记A、B、C。A桶为不分级絮体组;将前期培养絮体过300目筛网,经筛网滤过的絮体分入B桶;截留在筛网上的絮体分入C桶,C桶水体取自原絮体静置5h后的上清液。3个桶经充分曝气后,分别取15L注入9个有效容积为5L的反应器中培养不同粒径生物絮团。试验分3组,每组3个平行:A组为不分级絮体组,B组为<50μm絮体组,C组为>50μm絮体组。反应器中分别以氯化铵和葡萄糖作为氮源和碳源,以碳氮比为15分别加入0.19g氯化铵和1.88g葡萄糖进行10mg/L氨氮转化试验。取试验初始水样(A、B、C组各3个样)和氨氮转化结束水样(A、B、C组各3个样)各50mL,经0.22μm孔径滤膜抽滤后将滤膜于-80℃冰箱保存,试验结束后送至上海美吉生物科技有限公司进行高通量测序。
1.3试验指标与测定方法
1.3.1水质指标的测定
每隔1d检测水体的温度、pH、溶解氧,并测定水体总氮、总氨氮、亚硝态氮、硝态氮和溶解性有机碳。总氮采用过硫酸钾氧化—紫外分光光度法(型号UV2000,上海尤尼柯,中国,下同)测定。水样经0.45μm孔径滤膜抽滤后测定三态氮及溶解性有机碳。其中亚硝态氮采用N-(1-萘基)-乙二胺比色法测定,硝态氮含量采用紫外分光光度法测定,总氨氮含量测定采用钠氏试剂法,溶解性有机碳含量使用多功能碳氮元素分析仪(MultiN/C2100,德国)测定。
1.3.2絮团成分指标的测定
总固体悬浮颗粒物采用称量质量法测定;絮体经65℃烘干后使用碳氮元素分析仪测定絮体中的碳元素和氮元素含量,将氮元素由粗蛋白平均系数6.25换算成粗蛋白含量。
1.3.3生物絮团微生物样品的测定
按照OmegaWaterDNAKit(Omega,USA)的说明,提取水体中的DNA。将提取得到的细菌总DNA通过微量紫外分光光度计(NanoDrop®ND-1000,Wilmington,DE,USA)测定DNA质量浓度和纯度。采用通用引物338F(5′-ACTCCTACGGGA-GGCAGCA-3′)和806R(5′-GGACTACHVGG-GTWTCTAAT-3′)对絮团细菌16SrRNA基因的V3~V4区扩增,修饰后的通用引物含有不同的Tag标签用以区分不同样品。PCR扩增体系为20μL:5×FastPfuBuffer4μL、2.5mmol/LdNTPs2μL、ForwardPrimer(5μmol/L)0.8μL、ReversePrimer(5μmol/L)0.8μL、FastPfuPolymerase0.4μL、DNA模板10ng,补ddH2O至20μL。PCR扩增的反应条件:94℃,5min;30×(94℃,30s,54℃,30s,72℃,45s);72℃,10min。每个样品3个重复,利用上海美吉生物医药科技有限公司的MiSeqPE300测序仪(IlluminaIncSanDiegoCAUSA)完成序列测定。
相关知识推荐:水产养殖论文能投稿sci期刊吗
Miseq文库构建及Miseq测序:(1)通过PCR将Illumina官方接头序列添加至目标区域外端;(2)使用凝胶回收试剂盒TruSeqTMDNASamplePrepKit切胶回收PCR产物;(3)Tris-HCl缓冲液洗脱,2%琼脂糖电泳检测;(4)氢氧化钠变性,产生单链DNA片段。检测合格文库后,采用Miseq进行测序。
数据分析处理:采用Mothur软件将得到的16SrDNA基因序列在RDP数据库中进行嵌合体检验,充分去除嵌合体序列。为了得到每个运算分类单元(OUT)对应的物种分类信息,采用RDPclassifier贝叶斯算法对97%相似水平的运算分类单元代表序列进行分类学分析,用Mothur软件构建稀释性曲线[15]。
1.4去除效率计算公式
总氨氮去除效率计算公式:
R=(ρ1-ρ2)/ρ1×100%
式中,R为总氨氮的去除率(%);ρ1为初始的总氨氮质量浓度(mg/L);ρ2为终末的总氨氮质量浓度(mg/L)。
1.5数据分析
试验数据采用Excel软件进行结果统计,由Origin、AdobeIllustrator软件进行相关图表的绘制。试验数值用平均值±标准差形式表示,采用SPSS17.0统计软件对数据进行单因素方差分析,P<0.05为差异显著。
2结果
2.1絮体培养阶段水质及三态氮的动态变化
试验前50d稳定絮体培养阶段的三态氮及总氮变化趋势见图2。生物絮团在第43天亚硝态氮降至最低并趋于稳定,絮体基本形成。试验期间,各组温度18.4~28.4℃,溶解氧水平7.5~9.6mg/L、pH7.7~9.0,因前期絮体培养阶段加入少许盐,水体盐度为7.1~7.7,各组环境指标组间差距不显著(P>0.05)。3个处理组的碱度均维持在155~240mg/L。
2.2氨氮的转化
由图3中溶解性有机碳质量浓度及总氨氮质量浓度计算可知,3组反应器中溶解性有机碳含量与总氨氮含量的初始比值分别为16.24、15.01、14.07。试验期间,pH、溶解氧、温度等水质指标见表1,各组温度为22~23.5℃、溶解氧水平为8.2~8.7、pH为8.2~8.6,各组环境指标组间差异不显著(P>0.05)。3个处理组的碱度均维持在250mg/L,氨氮快速转化期间3个处理组碱度波动范围差异不显著(P>0.05)。
3组反应器初始氨氮质量浓度分别为(8.43±0.13)、(9.71±0.07)、(10.52±0.44)mg/L,在第2h,3组氨氮都达到峰值,分别为(16.46±1.34)、(17.93±1.91)、(18.62±1.19)mg/L,下降后均有回升,最后趋于稳定快速下降。由图3a可见,3组反应器基本均在12h将10mg/L总氨氮同化去除完毕,氨氮去除率分别达97.33%、95.28%和95.09%;总体上看,3组反应器对氨氮的同化去除速度是一样的,3组处理组的氨氮变化差异性不显著(P>0.05)。由图3b可见,反应过程中亚硝态氮有反复出现小幅度“先升后降”的状态,3组间差异不显著(P>0.05)。由图3c可见,3组反应器硝态氮含量上升下降起伏明显,均有少量增加后降低趋势,并低于初始值,3组反应器硝态氮变化差异不显著(P>0.05)。到反应结束,不额外产生亚硝态氮和硝态氮,与已有研究结果[1]相符。溶解性有机碳质量浓度呈持续下降趋势(图3d),不同絮团粒径组溶解性有机碳变化差异不显著(P>0.05)。
2.3絮体总固体悬浮物及粗蛋白
每组反应器取3个样品进行总悬浮固体物测定,以确定初始的总悬浮固体物质量浓度。10mg/L氨氮快速转化试验中,3组初始总悬浮固体物分别为(720.33±52.21)、(693±58.28)mg/L和(753.67±59.55)mg/L。由图4可见,3组的总悬浮固体物质量浓度在12h内的变化均有所升高,同时段不同粒径处理组之间总悬浮固体物质量浓度差异性不显著(P>0.05)。由表2可见,不同粒径处理组对絮体粗蛋白含量差异不显著(P>0.05)。
2.4微生物序列数目和多样性
分别取初始0h时间段与终末12h时间段絮体进行高通量测序多样性分析,絮体细菌原核16S序列数目和平均长度如表3所示。初始絮团更能准确反映不同粒径絮团的微生物群落丰度、多样性差异。通过比较sobs、ace和chao指数分析可知,初始微生物丰度由大到小排序为:<50μm絮体组,>50μm絮体组,不分级絮体组;由表3可见,初始微生物多样性由大到小排序为:不分级絮体组,>50μm絮体组,<50μm絮体组;三组处理组Shannon值差异性不显著(P>0.05)。终末时段各组微生物群落多样性均相对初始时段均有所降低。——论文作者:陈晓庆1,罗国芝1,2,3,谭洪新1,2,3,吴慧芳1,蒙浩焱1,黎爽1
转载请注明来自:http://www.lunwencheng.com/lunwen/nye/19533.html