摘 要:采用三相分离法提取纯化金银花中过氧化物酶,结果表明最优纯化条件为pH 5.60、硫酸铵质量浓度 39.49 g/100 mL、提取液与叔丁醇体积比1∶1.38,在该条件下纯化倍数为5.849,回收率为87.64%。金银花过氧化物酶比活力为1 021.6 U/mg,色素清除率为92%;酶学性质研究表明:金银花过氧化物酶最适温度为30 ℃,热稳定范围为10~40 ℃;最适pH值为5,pH值稳定范围为4~7。在金银花过氧化物酶催化的双底物酶促反应中,当H2O2浓度一定时,酶对愈创木酚的Km值为8.12 mmol/L,vmax值为1.71 mmol/(min·L)。当愈创木酚浓度一定时,H2O2的 Km值为0.822 mmol/L,vmax值为1.38 mmol/(min·L)。金银花过氧化物酶与底物的亲和力由强到弱依次是邻苯三酚、邻苯二酚、联甲氧基苯胺、愈创木酚。Ca2+、Cu2+、Zn2+对金银花过氧化物酶有激活作用,Mg2+、Mn2+、柠檬酸、抗坏血酸、L-半胱氨酸、亚硫酸钠、偏重亚硫酸钠、十二烷基磺酸钠对金银花过氧化物酶有不同程度的抑制作用。
关键词:金银花;过氧化物酶;三相分离法;酶学性质
金银花(Lonicera japonica Thunb.)为忍冬科植物忍冬的花蕾或初开的花,具有抑菌、抗病毒[1-3]、抗氧化[4-5]等作用,作为一种“药食同源”原料广泛用于食品生产[6-7]。新鲜金银花在储藏和干燥加工过程中,常发生不同程度的褐变,造成功效成分降解,导致药用价值的降低[8]。研究表明这种品质劣变是在多酚氧化酶和过氧化物酶(peroxidase,POD)等相关酶的作用下,酚类物质氧化为醌,醌类物质聚合形成褐色素而引起的[9-10]。目前金银花酶促褐变引起功效成分损失的具体途径尚未研究清楚,提取纯化相关酶对于金银花酶促褐变机理研究具有一定意义。
三相分离法是通过向粗提取液中加入一定比例的盐和有机溶剂使混合液产生明显的三相,使部分蛋白聚集在有机相和水相间的沉淀层,低分子质量色素、膜脂等溶解在有机层,糖类、部分蛋白质溶解在水层,从而达到提取纯化目标物质的方法[11-12]。研究表明三相分离法适用于部分植物组织中酶的初步纯化[12-16],此外三相分离法也可用于分离纯化油性树脂[17]、熊果酸、齐墩果酸[18]等天然物质。将三相分离法应用于植物组织中天然物质的纯化是一种较新的分离纯化技术[19],具有一定的应用前景。
本研究用三相分离法分离纯化金银花中的POD,一方面有助于纯化参与酶促褐变的相关酶,为进一步深入研究金银花中酶促褐变途径提供依据;另一方面对扩展三相分离体系在植物组织中酶的纯化方面的应用具有积极意义。
1 材料与方法
1.1 材料与试剂
新鲜金银花采摘于洛阳市孟津县益丰金银花种植基地。
磷酸氢二钠、磷酸二氢钾、无水乙醇、甘油、甲叉双丙稀酰胺、过氧化氢、丙烯酰胺 天津市德恩化学试剂有限公司;硫酸铵、甘氨酸 江苏强盛功能化学股份有限公司;愈创木酚 上海源叶生物科技有限公司;磷酸、盐酸、三羟甲基氨基甲烷 洛阳昊华化学试剂有限公司;叔丁醇、碱性品红、偏重亚硫酸钠、活性炭天津市科密欧化学试剂有限公司;考马斯亮蓝G-250、考马斯亮蓝R-250 上海强顺化学试剂有限公司;牛血清白蛋白 上海蓝季科技发展有限公司;溴酚蓝 天津市致远化学试剂有限公司;四甲基乙二胺 北京吉美生物技术有限公司;过硫酸铵 天津市大茂化学试剂厂;高碘酸钠、三氯乙酸 南京化学试剂有限公司。
1.2 仪器与设备
HR2850搅拌机 飞利浦电子公司;PHS-3C型精密 pH计 上海越平科学仪器有限公司;2400紫外-可见分光光度计 上海舜宇恒平科学仪器有限公司;H1850R 湘仪台式高速冷冻离心机 湖南长沙湘仪离心机仪器有限公司;DYCZ-24DN垂直板电泳槽、电泳仪 北京六一仪器厂。
1.3 方法
1.3.1 金银花POD的提取
称取一定量新鲜无损金银花,按照料液比 1∶7(g/mL)加入4 ℃的pH值为6的磷酸盐缓冲液打浆 2 min,4 ℃、9 000 r/min离心15min,收集上清液即为粗酶液,将粗酶液分装冻存备用。
1.3.2 三相分离法纯化POD
取20 mL酶的粗提取液,在100 r/min搅拌条件下缓慢加入一定量的硫酸铵,待硫酸铵固体充分溶解之后用 1 mol/L的HCl或NaOH溶液调节混合液的pH值,然后按照一定体积比加入叔丁醇,继续搅拌10 min,将混合液转移至离心管中,4 ℃静置1 h,4 000 r/min离心10 min。离心之后可以观察到混合液分为明显的三相,即上层的有机相、中间的沉淀层和下层的水相,用吸管吸除上层的有机相和下层水相。中间沉淀层用1 mL的pH值为6的磷酸盐缓冲液溶解,透析除去盐和有机溶剂,分别测定总蛋白含量和酶活力[11-12,16]。
1.3.3 单因素试验
首先固定硫酸铵质量浓度30 g/100 mL、提取液与叔丁醇体积比1∶1,考察pH值(3、4、5、6、7、8)对金银花POD回收率和纯化倍数的影响。在最优pH值条件下,固定提取液与叔丁醇体积比1∶1,考察硫酸铵质量浓度(20、30、40、50、60 g/100 mL)对金银花POD回收率和纯化倍数的影响。然后在最优pH值及硫酸铵质量浓度条件下,考察提取液与叔丁醇体积比(1∶0.5、1∶1、 1∶1.5、1∶2、1∶2.5)对金银花POD回收率和纯化倍数的影响。
1.3.4 金银花POD提取纯化的响应面试验
根据单因素试验结果,使用Box-Behnken试验设计,分析pH值、硫酸铵质量浓度、粗提取液与叔丁醇体积比在三相分离中对金银花POD分离纯化的影响。试验设计的因素与水平见表1。
1.3.5 酶活力测定
在比色杯中,先加入2 mL pH值为5的磷酸盐缓冲液,然后加入1 mL体积分数0.5%愈创木酚和0.1 mL体积分数0.1% H2O2溶液,最后加0.1 mL粗酶液,盖上盖子在比色皿中迅速混合均匀,30 ℃条件下在470 nm波长处测定吸光度,每隔20 s计1 次数,以吸光度每分钟变化0.01 为1 个酶活力单位[20]。
1.3.6 蛋白质含量的测定
采用Bradford的考马斯亮蓝G-250比色法[21]测定蛋白质含量,用牛血清蛋白制作标准曲线,以595 nm波长处的吸光度为纵坐标,以标准蛋白质质量(mg)为横坐标绘制标准曲线[22],根据标准曲线方程计算出样品中蛋白质质量。以标准蛋白质质量对吸光度进行线性回归得回归方程为:y=8.333x+0.034 3,R2 =0.998 1。
1.3.7 脱色效果测定
参考文献[23],通过全波长扫描,将418 nm作为金银花褐变色素测定波长,实验发现在418 nm波长处无扫描峰,选择在360、380、400、420、460 nm测定粗提取液吸光度,将粗提取液稀释不同的倍数,以使吸光度在 0.2~0.8范围内,选择线性最优的波长作为测定色素含量的最佳波长。
1.3.8 聚丙烯酰胺凝胶电泳实验
对粗提取液及经三相分离法提取纯化的金银花POD 进行聚丙烯酰胺凝胶电泳分析,凝胶分别用考马斯亮蓝染色、愈创木酚和H2O2溶液组成的底物溶液进行活性染色[25],以及高碘酸-Schiff试剂反应(periodic acid schiff reaction,PAS)染色[26]。
1.3.9 金银花POD酶学性质测定
1.3.9.1 金银花POD最适温度及热稳定性
分别在10~70 ℃温度下测定酶活力,以酶活力最高为100%。酶液在10~70 ℃条件下保温1 h后,迅速冷却至室温,测定残余酶的活力,以未保温处理4 ℃条件下放置1 h的酶活力为100%[27]。
1.3.9.2 金银花POD最适pH值及pH值稳定性
在不同pH值的缓冲溶液中测定酶活力,以酶活力最高者为100%。用不同pH值的缓冲溶液稀释酶液,4 ℃放置1 h,测定残余酶的活力,以酶活力最高者为100%[27]。
1.3.9.3 底物浓度对金银花POD反应速率的影响
在最适条件下使酶促反应体系的愈创木酚浓度分别为3.33、1.67、1.11、0.83、0.67、0.56、0.48 mmol/L,测得不同愈创木酚浓度下酶促反应的速率,以愈创木酚浓度的倒数为横坐标,以反应速率的倒数为纵坐标,求出金银花POD在该条件下的米氏常数Km值和最大速率 vmax值[27-28]。
在最适条件下使酶促反应体系的H2O2溶液浓度分别为0.333、0.167、0.111、0.083、0.067、0.056、 0.048 mmol/L,测得H2O2溶液不同浓度下酶促反应的速率,以H2O2溶液浓度的倒数为横坐标,以反应速率的倒数为纵坐标,求出金银花POD在该条件下的米氏常数Km 值和vmax值。
H2O2溶液浓度测定用经草酸钠标定的高锰酸钾溶液进行滴定。产物浓度[27]以愈创木酚氧化产物四联甲氧基连酚的消光系数ε470 nm为26.6 mmol·cm·mL计算。
1.3.9.4 金银花POD的底物特异性
在酶反应体系中分别以愈创木酚、邻苯二酚、邻苯三酚、联甲氧基苯胺为酶反应底物,测定不同底物浓度下酶促反应速率,用Lineweaver-Burk双倒数作图法,计算不同底物条件下酶促反应米氏方程,根据Km值判断金银花POD的底物专一性。
1.3.9.5 抑制剂和金属离子对金银花POD活性的影响
在酶反应体系中加入0.1 mL不同浓度的抑制剂(柠檬酸、抗坏血酸、L-半胱氨酸、亚硫酸钠、偏重亚硫酸钠、十二烷基磺酸钠)及金属离子(NaCl、CaCl2、 MgSO4、ZnSO4、CuSO4、MnSO4),在不同化合物浓度(0.1、1、10 mmol/L)条件下测定对酶活力的影响,以不添加化合物组为对照组,计算相对酶活力,测定不同化合物对金银花POD的激活及抑制作用。
2 结果与分析
2.1 单因素试验结果
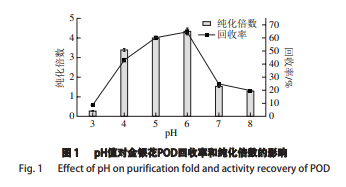
2.1.1 pH值对金银花POD回收率和纯化倍数的影响
在三相分离体系的参数优化中,pH值常作为首要考虑的因素[11]。由图1可知,回收率和纯化倍数都呈现先上升再下降的趋势,在pH 3~4和6~7之间变化程度较大,在pH值为6时达到最佳的提取纯化效果。原因可能是体系的分配效果常在目标蛋白等电点附近发生明显的变化[11-12]。当体系的pH值大于目标蛋白的等电点时,蛋白质因为携带负电荷而趋向于向水相层移动,当体系的pH值小于目标蛋白的等电点时,蛋白质因为携带正电荷而聚集在有机相层与水相层间的沉淀层。此外,当蛋白质携带正电荷时易与SO4 2-发生结合,而使蛋白结构紧缩而沉淀析出,这与 pH值对常规盐析的影响作用类似。因此,在pH值为5~6 时,有较好的提取纯化效果,当pH值大于6时,提取纯化效果下降。在pH值为3时效果较差可能是金银花POD在偏酸性环境下失活引起的。
2.1.2 硫酸铵对金银花POD回收率和纯化倍数的影响
由图2可知,在硫酸铵质量浓度为40 g/100 mL时,回收率和纯化倍数达到最大值,分别达到75.4%和5.36。三相分离体系对于蛋白质的分离纯化作用主要是盐析、有机溶剂沉淀、等电点沉淀、渗透和离子的亲液作用等[12]。 SO4 2-通过结合溶液中的自由水,使蛋白质的疏水基团暴露,随着盐浓度增大蛋白质由于疏水作用而聚集沉淀。因此,当硫酸铵质量浓度大于40 g/100 mL时,纯化倍数下降较快,回收率缓慢下降。
2.1.3 提取液与叔丁醇体积比对金银花POD回收率和纯化倍数的影响
从图3可以看出,提取液与叔丁醇体积比从1∶0.5改变到1∶1时,回收率和纯化倍数上升较快,提取液与叔丁醇体积比为1∶1.5时,回收率和纯化倍数达到最大值,分别为77.4%和5.67。叔丁醇因分子体积较大不能进入蛋白质分子结构内部,因而不易引起酶失活。此外可以与水互溶的叔丁醇在硫酸铵溶液中可以产生明显的分层,所以通常选择叔丁醇作为在三相分离体系中的有机溶剂[11]。叔丁醇可以从水相层吸收一定量的水而使硫酸铵浓度增大而引起沉淀层蛋白增多,同时,水相与有机相的浓度梯度增大可能会引起回收率和纯化倍数的减小[12,14]。因此回收率和纯化倍数随体积比的变化呈现先上升再下降的趋势。
2.2 金银花POD提取纯化的响应面结果
2.2.1 模型建立与显著性检验结果
2.2.2 模型双因素交互作用效应分析
应用Design-Expert V8.05绘制各指标与影响显著的两个自变量间的响应面和等高线图,考察拟合响应面的形状,分析交互项对回收率和纯化倍数的影响。由图4可知,pH值(X1)和提取液与叔丁醇体积比(X3)之间的交互作用对回收率和纯化倍数的影响达到极显著水平,原因可能是pH值影响分离体系中目标蛋白所带电荷,提取液与叔丁醇体积比影响硫酸铵浓度及两相间浓度梯度[12,14],两者相互作用,影响提取纯化效果。
利用Design-Expert V8.05进行工艺参数的优化组合,由回归方程优化得出因素水平的最优组合为pH 5.60、硫酸铵质量浓度39.49 g/100 mL、提取液与叔丁醇体积比1∶1.38。在该条件下纯化倍数为5.849,回收率为 87.64%。新鲜金银花中POD比活力为2 086.5 U/g,经三相法分离纯化,POD比活力为1 021.6 U/mg。
从图5可以看出,经过三相分离法的初步纯化,部分杂蛋白被去除。由于POD可将愈创木酚氧化为红褐色物质,从活性染色结果可以看到2 条较明显红褐色条带,说明该品种金银花具有2 种POD同工酶。由于POD 是一类含有血红素辅基的糖蛋白[29],因此通过PAS染色,可呈现紫色[30]。
2.4 脱色效果测定结果
金银花匀浆后极易发生褐变,产生大量色素,这些褐色素易与纤维素离子交换树脂结合,且较难洗脱,对进一步纯化产生影响。三相分离法对色素物质有一定分离效果,可用于褐色素的清除。由图6可知,在380、 400、420、440、460 nm波长范围内对色素浓度与吸光度进行线性拟合,R2 分别为0.974 2、0.976 0、0.988 2、 0.971 2、0.961 6,在420 nm波长处色素浓度与吸光度的线性关系最优,因此选择420 nm作为色素浓度测定波长。在回归方程优化得出因素水平的最优组合条件下色素清除率可达92%。
2.5 金银花POD最适温度及热稳定性分析
从 图 7 可以看出,金银花 POD 相对酶活力在 10~70 ℃范围内呈现先上升再下降的趋势,相对酶活力在30 ℃时达到最大值,在温度超过50 ℃后相对酶活力下降迅速,70 ℃时相对酶活力只有33%。从金银花POD热稳定性曲线可以看出在10~40 ℃范围内相对酶活力较为稳定,40 ℃时相对酶活力为77.1%,同时温度大于40 ℃后,酶稳定性迅速下降,70 ℃保温1 h,相对酶活力为7.7%。
2.6 金银花POD最适pH值及pH值稳定性分析
从图8可以看出,金银花POD在pH 4~7范围内有较高活性,该酶的最适pH值为5,在pH值为4时相对酶活力为87%,pH值为6时相对酶活力为84%;从pH值稳定性曲线中可以看出在pH值在2~5范围内酶稳定性变化明显,相对酶活力从20%上升到100%,pH值在5~9范围内酶稳定性变化较缓慢,相对酶活力从100%变化到 71%。可能是pH值小于4的酸性环境对金银花POD分子结构稳定性影响较大,在pH 4~7的碱性环境中酶的分子构象较稳定。 2.7 底物浓度对金银花POD反应速率的影响
POD催化的酶促反应属于双底物酶促反应,固定一种底物的浓度,测定不同浓度的另一种底物对反应速率的影响,用Lineweaver-Burk双倒数作图法,可以得到两条双倒数曲线,双倒数曲线中横轴截距为-1/Km,纵轴截距为1/vmax。由图9金银花POD的双倒数曲线可以求出当H2O2溶液浓度一定时,POD对愈创木酚的Km值为 8.12 mmol/L,vmax值为1.71 mmol/(min·L)。当愈创木酚溶液浓度一定时,H2O2的Km值为0.822 mmol/L,vmax值为1.38 mmol/(min·L)。Km值是酶促反应速率达到最大反应速率一半时的底物浓度,可以代表酶与底物的亲和能力[27]。因此可以看出H2O2溶液对于金银花POD的亲和能力大于愈创木酚溶液。
2.8 金银花POD的底物专一性
分别以愈创木酚、邻苯二酚、邻苯三酚、联甲氧基苯胺作为反应底物,用Lineweaver-Burk双倒数作图法可以得到不同底物条件下酶促反应的米氏方程,米氏常数 Km可以代表酶与底物的亲和能力,Km值愈小,表明酶与底物的亲和力越强,从表5可以看出,金银花POD与底物的亲和力由强到弱依次为邻苯三酚、邻苯二酚、联甲氧基苯胺、愈创木酚。
2.9 抑制剂和金属离子对金银花POD活力的影响
3 结 论
在单因素试验的基础上经响应面优化得出各因素水平的最优组合为pH 5.60、硫酸铵质量浓度 39.49 g/100 mL、提取液与叔丁醇体积比为1∶1.38。在该条件下纯化倍数为5.849,回收率为87.64%。该条件下 POD比活力为1 021.6 U/mg。
420 nm可作为金银花褐变产生色素的测定波长。三相分离法对褐变色素具有较好的清除效果,在最优纯化效果条件下色素清除率为92%。
对金银花POD最适温度和热稳定性研究表明酶的最适温度30℃,该酶在10~40 ℃范围内稳定性较好,相对酶活力在75%以上,当温度高于40 ℃酶活力下降迅速。对最适pH值和pH值稳定性研究表明酶的最适pH值为5,酶在pH值小于4的酸性环境中酶活力下降迅速, pH值在4~7范围内有较好的稳定性。当H2O2溶液浓度一定时,酶对愈创木酚的Km值为8.12 mmol/L,vmax值为 1.71 mmol/(min·L)。当愈创木酚溶液浓度一定时,H2O2溶液的K m值 为0.822 mmol/L,v max值 为 1.38 mmol/(min·L)。H2O2溶液对于金银花POD的亲和能力大于愈创木酚。金银花POD与底物的亲和力由强到弱依次是邻苯三酚、邻苯二酚、联甲氧基苯胺、愈创木酚。Ca2+、Cu2+、Zn2+对金银花POD有一定激活作用,Mg2+、Mn2+、柠檬酸、抗坏血酸、L-半胱氨酸、亚硫酸钠、偏重亚硫酸钠、十二烷基磺酸钠对金银花POD 均有一定抑制作用。——论文作者:罗 磊,董金龙,朱文学*,薛依涵,关宁宁,张 宽,姬青华
参考文献:
[1] 王清, 朱萱萱, 张赤兵, 等. 金银花提取物抗菌作用的实验研究[J]. 中国医药导刊, 2008, 10(9): 1428-1430.DOI:10.3969/j.issn.1009-0959.2008.09.068.
[2] 康旭, 李冬生, 邓川, 等. 金银花提取液抑菌活性的研究[J]. 安徽农业科学, 2010, 38(27): 14935-14936. DOI:10.3969/j.issn.0517-6611.2010.27.046.
[3] RAHMAN A, KANG S C. In vitro control of food-borne and food spoilage bacteria by essential oil and ethanol extracts of Lonicera japonica Thunb.[J]. Food Chemistry, 2009, 116(3): 670-675. DOI:10.1016/j.foodchem.2009.03.014.
[4] 关炳峰, 谭军, 周志娣. 金银花提取物的抗氧化作用与其绿原酸含量的相关性研究[J]. 食品工业科技, 2007, 28(10): 127-129. DOI:10.3969/j.issn.1002-0306.2007.10.037.
[5] 杨利军, 田迪英. 11 种中草药抗氧化活性与黄酮含量相关性研究[J]. 食品工业科技, 2008(1): 119-120; 123.
[6] 马雪梅, 吴朝峰. 河南省金银花产业发展现状及思路[J]. 湖北农业科学, 2012, 51(6): 1185-1188. DOI:10.3969/j.issn.0439-8114.2012.06.030.
[7] 石钺, 石任兵, 陆蕴如. 我国药用金银花资源、化学成分及药理研究进展[J]. 中国药学杂志, 1999, 34(11): 724-727. DOI:10.3321/ j.issn:1001-2494.1999.11.002.
[8] 罗磊, 郭晓园. 金银花中绿原酸的研究进展[J]. 农产品加工, 2008(8): 60-62. DOI:10.3969/j.issn.1671-9646-C.2008.08.037.
[9] 侯爽爽, 罗磊. 金银花热风干燥过程中颜色的劣变机理[J]. 农产品加工学刊, 2010(10): 63-65. DOI:10.3969/j.issn.1671- 9646(X).2010.10.019.
转载请注明来自:http://www.lunwencheng.com/lunwen/nye/21559.html